 A 63ª edição da ASH apresenta em Sessão Plenária os resultados do ZUMA-7 (NCT03391466), um estudo global, randomizado, de Fase 3, que avaliou a terapia celular CAR T com Axicabtagene Ciloleucel (Axi-Cel/ Yescarta®) versus terapia padrão em pacientes com linfoma de grandes células B recorrente ou refratário (LBCL R / R). Os dados mostram benefício clínico e estatisticamente significativo com a terapia celular CAR T, com sobrevida livre de eventos mais que 4 vezes superior ao padrão de tratamento (8,3 meses versus 2,0 meses; HR 0,398, p <0,0001), o dobro da taxa de resposta completa e perfil de segurança manejável. Diante desses resultados, Axi-Cel demonstrou que pode substituir a quimioimunoterapia e o transplante autólogo como padrão de segunda linha nessa população de pacientes. Nesta análise, foram considerados pacientes ≥18 anos com LBCL, ECOG PS 0–1, doença R / R ≤12 meses e tratamento prévio com anticorpo monoclonal anti-CD20 e antraciclina. O estudo teve publicação simultânea na New England Journal of Medicine (NEJM).
A 63ª edição da ASH apresenta em Sessão Plenária os resultados do ZUMA-7 (NCT03391466), um estudo global, randomizado, de Fase 3, que avaliou a terapia celular CAR T com Axicabtagene Ciloleucel (Axi-Cel/ Yescarta®) versus terapia padrão em pacientes com linfoma de grandes células B recorrente ou refratário (LBCL R / R). Os dados mostram benefício clínico e estatisticamente significativo com a terapia celular CAR T, com sobrevida livre de eventos mais que 4 vezes superior ao padrão de tratamento (8,3 meses versus 2,0 meses; HR 0,398, p <0,0001), o dobro da taxa de resposta completa e perfil de segurança manejável. Diante desses resultados, Axi-Cel demonstrou que pode substituir a quimioimunoterapia e o transplante autólogo como padrão de segunda linha nessa população de pacientes. Nesta análise, foram considerados pacientes ≥18 anos com LBCL, ECOG PS 0–1, doença R / R ≤12 meses e tratamento prévio com anticorpo monoclonal anti-CD20 e antraciclina. O estudo teve publicação simultânea na New England Journal of Medicine (NEJM).
Os pacientes elegíveis foram randomizados 1: 1 para receber Axi-Cell ou tratamento padrão (SOC), estratificados pela resposta à quimioterapia de primeira e segunda linha (1L e 2L) ajustada para a idade. No braço Axi ‑ Cel, os pacientes receberam infusão única de 2 × 106 células CAR T/ kg após o regime de condicionamento (ciclofosfamida 500 mg / m2 / dia e fludarabina 30 mg / m2 / dia, por 3 dias). No braço de tratamento padrão, os pacientes receberam 2–3 ciclos de quimioimunoterapia baseada em platina. Aqueles com resposta parcial ou resposta completa foram aptos a HDT-ASCT.
Embora não tenha havido cruzamento experimental planejado entre os braços de análise, os pacientes que não responderam à terapia padrão tiveram autorização para receber tratamento com células CAR T fora do protocolo. Avaliações pré-especificadas foram feitas por PET-CT de acordo com a classificação de Lugano. O endpoint primário foi a sobrevida livre de eventos (EFS, da sigla em inglês) por revisão central independente e cega. Os principais endpoints secundários, foram taxa de resposta objetiva (ORR, da sigla em inglês) e sobrevida global (SG, análise provisória), além de dados de segurança. O nível de células CAR T foi um endpoint exploratório.
Resultados
ZUMA-7 foi iniciado em 2017 e contou com a participação de 77 centros em todo o mundo. Os resultados divulgados nesta análise representam o tempo de acompanhamento mais longo de qualquer estudo neste cenário, com acompanhamento médio de dois anos (24,9 meses).
Em 18/03/21, o ensaio ZUMA-7 somava 359 pacientes inscritos, com mediana de 59 anos (variação, 21-81; 30% ≥65 anos). Dessa população, 74% tinham doença primariamente refratária e 46% resposta ao tratamento inicial. De 180 pacientes randomizados para Axi-Cel, 170 (94%) foram infundidos; de 179 pacientes randomizados para SOC, 64 (36%) alcançaram condições para HDT-ASCT após quimioimunoterapia de 2L.
Em um seguimento mediano de 24,9 meses, o endpoint primário de sobrevida livre de eventos foi alcançado (HR: 0,398; P <0,0001) e a EFS mediana foi significativamente maior com Axi-Cel vs SOC (8,3 meses [IC de 95%: 4,5–15,8] versus 2 meses [IC de 95%: 1,6–2,8], respectivamente), assim como a estimativa de Kaplan- Meier em 24 meses foi significativamente superior com Axi-Cel (41% vs 16%).
O tratamento com Axi-Cel também foi associado a taxas de resposta objetiva e resposta completa (CR) maiores na comparação com SOC (ORR: 83% vs 50%, odds ratio: 5,31 [IC de 95%: 3,1–8,9; P <0,0001]; CR: 65% vs 32 %). A tendência de sobrevida global avaliada na análise provisória pré-planejada favoreceu Axi-Cel vs SOC (não atingida vs 35,1 meses, respectivamente; HR: 0,730; P = 0,027), embora os dados estejam imaturos. No braço SOC, 100 pacientes (56%) receberam terapia com células CAR T comercialmente disponível ou agentes experimentais fora do protocolo como terapia subsequente.
Em relação ao perfil de segurança, eventos adversos de grau ≥3 relacionados ao tratamento ocorreram em 155 (91%) e em 140 (83%) pacientes nos braços Axi-Cel e SOC, respectivamente, e mortes relacionadas ao tratamento ocorreram em 1 paciente no braço Axi-Cel e em 2 que receberam tratamento padrão. No grupo Axi-Cel, a síndrome de liberação de citocinas de grau ≥3 ocorreu em 11 (6%) pacientes (tempo mediano de início em 3 dias; duração mediana de 7 dias) e eventos neurológicos de grau ≥3 ocorreram em 36 (21%) pacientes (tempo médio para o início 7 dias; duração média 8,5 dias). Não foram reportados eventos de grau 5 relacionados à síndrome de liberação de citocinas ou à neurotoxicidade.
O nível médio de células CAR T de pico foi de 25,8 células / µL; o tempo médio para atingir o pico foi de 7 dias após a infusão.
“ZUMA-7 é o primeiro estudo randomizado, global, multicêntrico de Fase 3 de Axi-Cel versus SOC em pacientes com linfoma de grandes células B recorrente ou refratário e demonstrou melhora clínica e estatisticamente significativa nessa população, com mediana de sobrevida livre de eventos 4 vezes maior, EFS 2,5 vezes maior em 2 anos, o dobro da taxa de resposta completa e mais que o dobro de pacientes que receberam tratamento definitivo. A segurança de Axi-Cel foi gerenciável, demonstrando que Axi-Cel pode substituir a quimioimunoterapia e o HDT-ASCT como padrão de segunda linha em pacientes com LBCL R / R”, concluem os autores.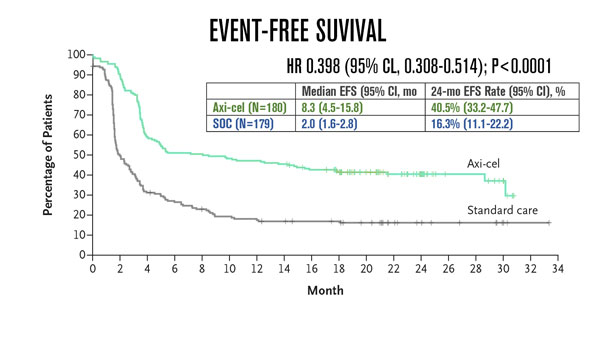 Assista vídeo exclusivo sobre o mesmo assunto:
Assista vídeo exclusivo sobre o mesmo assunto:
Referência: 2 Primary Analysis of ZUMA‑7: A Phase 3 Randomized Trial of Axicabtagene Ciloleucel (Axi-Cel) Versus Standard‑of‑Care Therapy in Patients with Relapsed/Refractory Large B-Cell Lymphoma - Frederick L. Locke et al.
Program: General Sessions
Session: Plenary Scientific Session
Hematology Disease Topics & Pathways:
Clinical Trials, Biological, Adults, Lymphomas, Non-Hodgkin Lymphoma, Clinical Research, Chimeric Antigen Receptor (CAR)-T Cell Therapies, Immune Mechanism, B Cell Lymphoma, Diseases, Therapies, Lymphoid Malignancies, Biological Processes, Study Population