 O estudo CLL2-GIVe avaliou a eficácia do tratamento combinado de tempo limitado, resposta adaptada e duração fixa de obinutuzumabe, ibrutinibe e venetoclax (regime “GIVe”) em pacientes com leucemia linfocítica crônica sem tratamento prévio com deleção 17p e/ou mutação TP53. No ASH 2022 foi apresentada a análise final do estudo, sugerindo que o regime CLL2-GIVe é um potente e promissor tratamento de primeira linha de duração fixa para pacientes com LLC de alto risco com perfil de segurança manejável.
O estudo CLL2-GIVe avaliou a eficácia do tratamento combinado de tempo limitado, resposta adaptada e duração fixa de obinutuzumabe, ibrutinibe e venetoclax (regime “GIVe”) em pacientes com leucemia linfocítica crônica sem tratamento prévio com deleção 17p e/ou mutação TP53. No ASH 2022 foi apresentada a análise final do estudo, sugerindo que o regime CLL2-GIVe é um potente e promissor tratamento de primeira linha de duração fixa para pacientes com LLC de alto risco com perfil de segurança manejável.
O CLL2-GIVe é um estudo aberto, multicêntrico, de Fase 2, que incluiu pacientes com LLC sem tratamento prévio com deleção (17p) e/ou mutação TP53. A terapia de indução continha 6 ciclos (C) de obinutuzumabe (GA-101), ibrutinibe, e venetoclax; venetoclax e ibrutinibe foram continuados como consolidação até p ciclo 12 (C12).
A monoterapia com ibrutinibe foi administrada nos ciclos 13 (C13) ao 36 (C36) em pacientes que não alcançaram uma resposta completa (CR) e doença residual mínima indetectável (uMRD) nos ciclos 9 e 12. O endpoint primário foi a taxa de resposta completa no ciclo 15 (reestadiamento final) com uma hipótese nula de 25%. Os endpoints secundários incluíram doença residual mínima, sobrevida e segurança.
Resultados
Entre setembro de 2016 e agosto de 2018 foram inscritos 41 pacientes. O último paciente chegou ao final do estudo em janeiro de 2022. A mediana de idade foi de 62 (intervalo 35-85) anos, deleção do 17p estava presente em 26 pacientes, mutação TP53 em 39 pacientes e 32 pacientes tinham um status de IGHV não mutado. Com uma taxa de resposta completa de 58,5% (24 pacientes) no reestadiamento final (C15), o desfecho primário foi alcançado (95% CI: 42,1-73,7, p<0,001); a taxa de remissão parcial (PR) foi de 41,5% (17 pacientes).
Doença residual mínima indetectável (uMRD) de sangue periférico no ciclo 15 foi alcançada em 32 pacientes (78%). Após um tempo médio de observação de 38,4 (3,7 – 44,9) meses, ocorreram 9 eventos de sobrevida livre de progressão (SLP) e 3 eventos de sobrevida global (SG). A sobrevida global de 36 meses é de 92,6% (Figura 1a) e a mediana de sobrevida global não foi atingida.
Três pacientes morreram (1 paciente no ciclo 3 devido a câncer de ovário pré-existente retrospectivamente, 1 paciente no ciclo 9 devido a insuficiência cardíaca não relacionada ao tratamento do estudo, e um paciente devido a infecção do trato respiratório após transformação de Richter (RT) sob tratamento subsequente). A taxa de SLP aos 36 meses é de 79,9% e a mediana de SLP não foi atingida (Figura 1b).
Doença progressiva (PD) foi observada em 7 pacientes entre os ciclos 27 e 42. A doença progressiva foi nodal (n=3) ou linfocitose (n=3), e ocorreu 1 caso de transformação de Richter (RT). Os tratamentos subsequentes foram administrados em 4 pacientes (1 paciente com 3 terapias: venetoclax, idelalisib/rituximab, ibrutinib; obinutuzumab (n=1); acalabrutinib/venetoclax/obinutuzumab (n=2)).
Seis pacientes receberam tratamento de manutenção completo com ibrutinibe após o ciclo 15 devido a remissão parcial no reestadiamento final, 3 deles também tinham MRD detectável. Nenhum desses pacientes progrediram. 6 pacientes com remissão parcial e doença residual mínima indetectável (uMRD) descontinuaram o tratamento no ciclo 15 fora do protocolo: 2 pacientes interromperam devido a evento adverso (AE); 4 pacientes devido a outros motivos. 5 pacientes com remissão parcial que descontinuaram o tratamento no C15 fora do protocolo não tiveram uMRD: 2 pacientes interromperam devido a evento adverso, 1 paciente devido a morte, 1 paciente devido a outros motivos, e 1 paciente recusou a manutenção com ibrutinibe.
No ciclo 36 (C36), 18 (43,9%) dos pacientes tinham uMRD no sangue periférico, enquanto 12 pacientes (29,3%) tinham MRD detectável: 8 pacientes eram MRD intermediário (≥ 10-4 e < 10-2) (19,5%), 4 pacientes positivo (≥10-2) (9,8%). Em 11 pacientes (26,8%) a análise não foi realizada devido a morte (n=2), início de uma nova terapia para LLC (n=2), retirada de consentimento informado (n=1), visitas perdidas durante a pandemia de Covid19 (n=3), e 3 pacientes foram perdidos no follow up.
Os eventos adversos de grau 3-5 mais frequentes até o final do estudo foram desordens hematológicas e do sistema linfático (58,5%), com neutropenia (48,8%) e trombocitopenia (17,1%), e infecções (19,5%). Os eventos adversos mais frequentes de qualquer grau foram distúrbios gastrointestinais em 85,4% dos pacientes, a maioria deles de baixo grau. O distúrbio cardíaco mais comum de qualquer grau foi a fibrilação atrial em 14,6% dos pacientes.
“O regime CLL2-GIVe é um potente e promissor tratamento de primeira linha de duração fixa para pacientes com LLC de alto risco com um perfil de segurança manejável, e merece investigações adicionais em estudos de Fase 3”, concluíram os autores.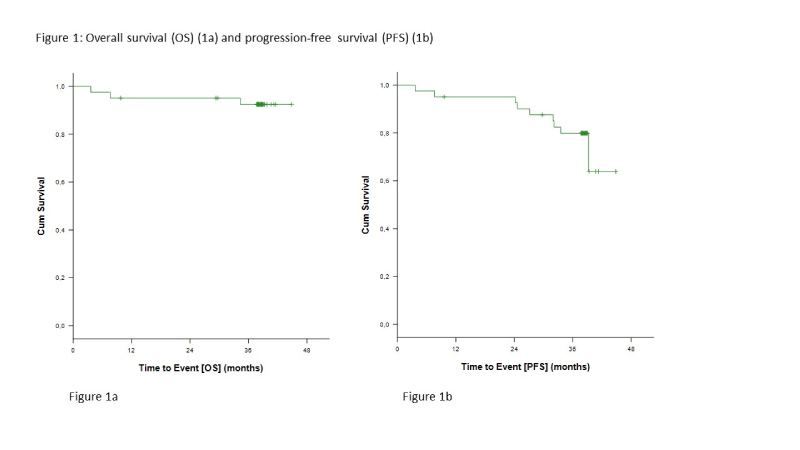 Referência: 343 Final Analysis of the Prospective Multicenter CLL2-Give Trial of Obinutuzumab (GA101, G), Ibrutinib (I), and Venetoclax (Ve) in Untreated Patients with CLL with 17p Deletion/TP53 Mutation
Referência: 343 Final Analysis of the Prospective Multicenter CLL2-Give Trial of Obinutuzumab (GA101, G), Ibrutinib (I), and Venetoclax (Ve) in Untreated Patients with CLL with 17p Deletion/TP53 Mutation
Program: Oral and Poster Abstracts
Type: Oral
Session: 642. Chronic Lymphocytic Leukemia: Clinical and Epidemiological: Targeted Triplet Combinations and Richter’s Transformation
Saturday, December 10, 2022: 4:00 PM
Henriette Huber et al