A oncologista Hope Hugo (foto), da Universidade da California e do UCSF Helen Diller Family Comprehensive Cancer Center, apresentou no SABCS 2023 resultados de qualidade de vida relatados pelos pacientes com câncer de mama avançado tratados com capivasertib. Os resultados do PRO (Patient-reported outcomes) do ensaio CAPItello-291 apoiam ainda mais o benefício de capivasertib nesta população.
A oncologista Hope Hugo (foto), da Universidade da California e do UCSF Helen Diller Family Comprehensive Cancer Center, apresentou no SABCS 2023 resultados de qualidade de vida relatados pelos pacientes com câncer de mama avançado tratados com capivasertib. Os resultados do PRO (Patient-reported outcomes) do ensaio CAPItello-291 apoiam ainda mais o benefício de capivasertib nesta população.
Neste estudo de Fase 3 (NCT04305496), a adição de capivasertib a fulvestranto (F) no tratamento do câncer de mama avançado HR+/HER2− (HER2− definido como IHC 0 ou 1+ ou IHC2 +/ISH –) melhorou significativamente a sobrevida livre de progressão (SLP) versus placebo + F (HR 0,60, IC 95% 0,51, 0,71, p<0,001) em pacientes com resistência ao inibidor da aromatase e naqueles com alteração da via AKT (HR 0,50, IC 95% 0,38, 0,65, p< 0,001).
O perfil de segurança de capivasertibe foi manejável e diarreia (principalmente grau 1) foi o evento adverso mais frequente. A análise do estado de saúde global (GHS)/ qualidade de vida relacionada à saúde (QVRS) foi mantida desde o início em ambos os braços e o tempo para deterioração (TTD) favoreceu o grupo tratado com capivasertib.
No SABCS 2023, resultados relatados pelos pacientes (PRO) consideraram QVRS, sintomas relacionados à doença, status funcional e relatos do paciente sobre a tolerabilidade do tratamento, a partir de questionários validados (EORTC QLQ-C30; EORTC QLQ-BR23 e a versão PRO dos Common Terminology Criteria for Adverse Events (PRO-CTCAE), além da avaliação sobre a Impressão Global do Paciente sobre Tolerabilidade ao Tratamento (PGI-TT).
Os pacientes foram randomizados 1:1 para receber F (500 mg IM nos dias 1 e 15 do ciclo 1 e no dia 1 de cada ciclo subsequente de 28 dias) com placebo (P) ou Capivasertib (400 mg BID; 4 dias, com 3 dias de intervalo). Os PROs foram avaliados em momentos pré-especificados. Para avaliar mudanças desde a linha de base os pesquisadores usaram medidas de repetição de modelo misto (pontuações durante o tratamento) para EORTC QLQ-C30 e resumidas para EORTC QLQ-BR23; O TTD foi avaliado usando o teste log-rank estratificado.
No geral, 708 pacientes foram randomizados para Capivasertib + Fulvestranto (CF; n = 355) ou Placebo + Fulvestranto (PF; n = 353). Taxas gerais de conformidade com EORTC QLQ-C30 e PGI-TT foram 84,5% e 80,6% com CF e 81,8% e 81,7% com PF,respectivamente. As taxas de conformidade basal com o EORTC QLQ-C30 e PGI-TT foram de 88,2% e 82,8% com CF e 87,3% e 83,1% com PF, respectivamente.
Em relação à linha de base, as pontuações funcionais e nos domínios de sintomas do EORTC QLQ-C30 foram mantido com CF e PF, exceto para diarreia no braço CF, onde os escores pioraram por >10 pontos (veja tabela).
A análise TTD mostrou que os HRs favoreceram CF vs PF para todos os domínios funcionais e de sintomas, exceto diarreia (HR 2,75; IC 95% 2,01; 3,81), que favoreceu PF (tabela). TTD mediano de diarreia foi mais curta com CF vs PF, em linha com o perfil de segurança de CF. A diarréia com CF foi controlável e as interrupções devido a diarreia foram baixas (2,0%; n=7/355).
Para o IGP-TT, a maioria dos pacientes relatou que ‘não se sentia nem um pouco’ ou ‘um pouco’ incomodado pelos efeitos da terapia do câncer. Durante os primeiros 6 meses, a proporção de pacientes que relatou ser ‘um pouco’, ‘bastante’ ou ‘muito’ incomodado pelos efeitos colaterais foi maior para CF vs PF, com diferenças entre os braços mais altas nos primeiros 2 ciclos.
“Os pacientes tratados com CF mantiveram a QVRS por mais tempo do que aqueles tratados com PF em todos os domínios funcional e de sintomas avaliados pelo QLQ-C30, exceto diarreia. O agravamento da diarreia foi observado com CF, o que é consistente com o perfil de segurança de capivasertib, mas os eventos pareceram toleráveis e não impactar negativamente a GHS/QVRS. Juntamente com a eficácia clínica e segurança gerenciável do perfil de CF, os resultados PRO do ensaio CAPItello-291 apoiam ainda mais um benefício positivo da combinação nesta população”, concluem os autores.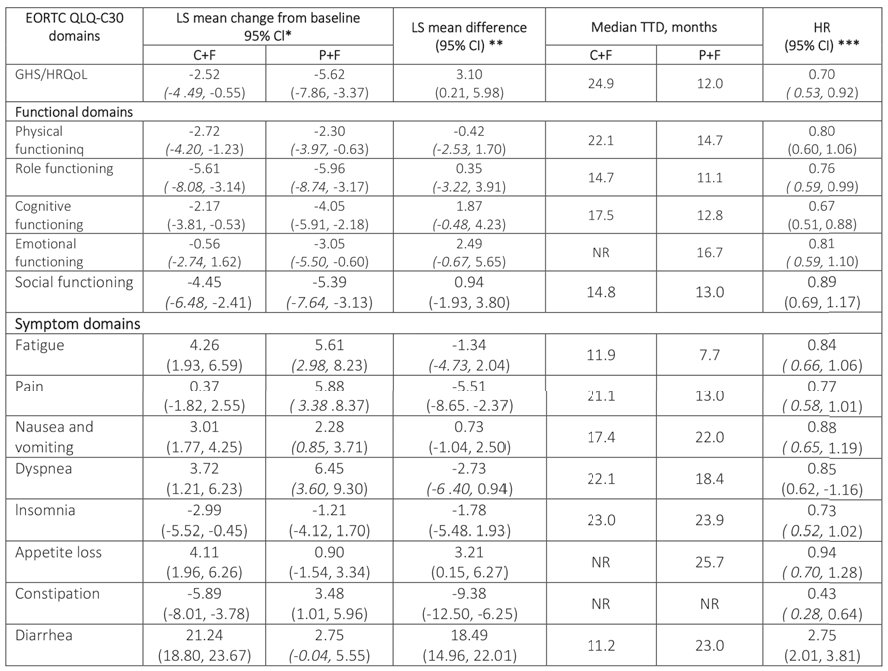
O estudo CAPItello-291 é patrocinado pela AstraZeneca e está registrado na plataforma Clinical trials.gov: NCT04305496.
Referência: PS02-02: Patient-reported outcomes from the Phase 3 CAPItello-291 trial investigating capivasertib and fulvestrant for patients with aromatase inhibitor-resistant HRpositive/HER2-negative advanced breast cancer