 Em mais um tópico da coluna ‘Drops de Genômica’, o oncologista André Murad (foto) questiona a carga mutacional tumoral (TMB) como um biomarcador universal de sensibilidade aos inibidores de checkpoint imune. Confira.
Em mais um tópico da coluna ‘Drops de Genômica’, o oncologista André Murad (foto) questiona a carga mutacional tumoral (TMB) como um biomarcador universal de sensibilidade aos inibidores de checkpoint imune. Confira.
Por André Murad*
A TMB é um preditor independente recém-estabelecido de sensibilidade de vários tumores sólidos ao tratamento com inibidores de checkpoint (ICIs) imune. Técnicas de sequenciamento de próxima geração (NGS) tumoral permitem que a TMB seja estimada de forma confiável a partir de um subconjunto do exoma tumoral sem a necessidade de sequenciamento do exoma inteiro, facilitando assim a adoção da avaliação de TMB de forma menos complexa e dispendiosa.
As análises de inúmeros ensaios clínicos em vários tipos de câncer demonstraram que a TMB estratifica os pacientes que estão recebendo ICIs por taxa de resposta e ganho de sobrevida.
Em 16 de junho de 2020, a Food and Drug Administration (FDA) americano concedeu aprovação acelerada ao pembrolizumabe para o tratamento em pacientes adultos e pediátricos com tumores sólidos metastáticos que progrediram a tratamentos convencionais e que apresentam TMB elevada, definida como ≥10 mutações por megabase pelo ensaio da FoundationOneCDx (Foundation Medicine, Inc.).
A aprovação se baseou nos resultados do estudo KEYNOTE-158, no qual a eficácia da TMB foi investigada em uma análise retrospectiva planejada prospectivamente de 10 coortes de pacientes com vários tumores sólidos metastáticos ou irressecáveis previamente tratados e com TMB elevada, o que correspondeu a 13% de um total de 102 pacientes avaliados.
A taxa de resposta objetiva foi de 29%, a taxa resposta completa foi de 4% e a mediana de duração de resposta não foi atingida, com 57% dos pacientes apresentando durações de resposta ≥12 meses e 50% dos pacientes apresentando durações de resposta ≥24 meses.
Entretanto, um estudo mais recente publicado por McGrail e colaboradores na revista Annals of Oncology questiona essa universalidade. Nesse estudo, dados de mais de 10 mil pacientes com tumores incluídos no The Cancer Genome Atlas (TCGA) foram usados para determinar a TMB e identificar a correlação entre a carga de neoantígeno prevista e as células T CD8. A associação de TMB com os resultados do tratamento com ICI foi analisada por ambas as taxas de resposta objetiva (N = 1551) e sobrevida global (N = 1936).
Os resultados sugerem que o status da TMB pode não ser confiável como um biomarcador universal para prever a resposta da imunoterapia. Embora a TMB tenha sido capaz de prever com sucesso a resposta aos ICIs em tumores como melanoma, câncer de pulmão e câncer de bexiga, não houve associação com melhores resultados em outros cânceres como mama, próstata e cerebrais (gliomas, GBM).
Este estudo representa a análise mais abrangente até o momento da TMB como um biomarcador de resposta aos inibidores de checkpoint e seus resultados não recomendam a aplicação da TMB como um biomarcador universal para resposta de imunoterapia.
Estudos adicionais específicos por tipo de tumor e tipo de mutações são necessários para esclarecer a melhor forma de aplicar o status da TMB nos tipos de câncer para os quais esse biomarcador parece não estar relacionada aos melhores resultados.
Sabemos, por exemplo, que nem todas as mutações não sinônimas são produtoras de neoantígenos imuno-sensibilizantes: enquanto as mutações que mudam a matriz de leitura (frameshifts) são qualitativamente eficazes na produção destas proteínas, mutações sem sentido (dos códons de parada) e mesmo as mutações indel com trocas de sentido podem não produzir proteínas altamente imunogênicas. 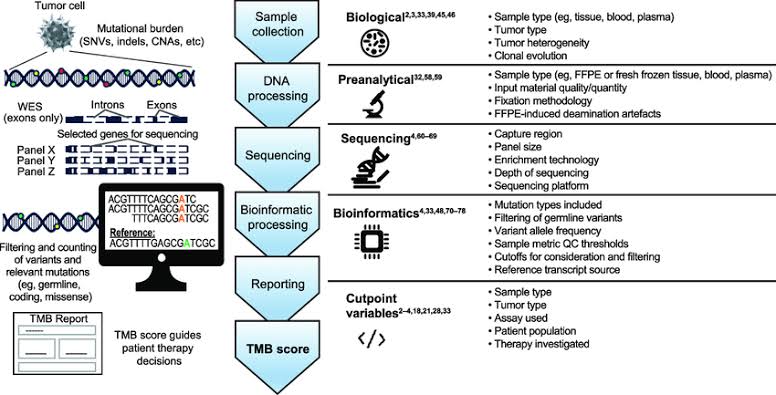
*André Murad é diretor científico do Grupo Brasileiro de Oncologia de Precisão (GBOP), diretor clínico da Personal - Oncologia de Precisão e Personalizada, professor adjunto coordenador da Disciplina de Oncologia da Faculdade de Medicina da UFMG, e oncologista e oncogeneticista da CETTRO Oncologia (DF)




