Em mais um tópico da coluna 'Drops de Genômica', o oncologista André Murad (foto) aborda as mutações de reversão do gene BRCA, que restauram a função BRCA anteriormente ausente e a capacidade das células de se auto-repararem através do mecanismo de recombinação homóloga. Confira.
Em mais um tópico da coluna 'Drops de Genômica', o oncologista André Murad (foto) aborda as mutações de reversão do gene BRCA, que restauram a função BRCA anteriormente ausente e a capacidade das células de se auto-repararem através do mecanismo de recombinação homóloga. Confira.
Por André Marcio Murad*
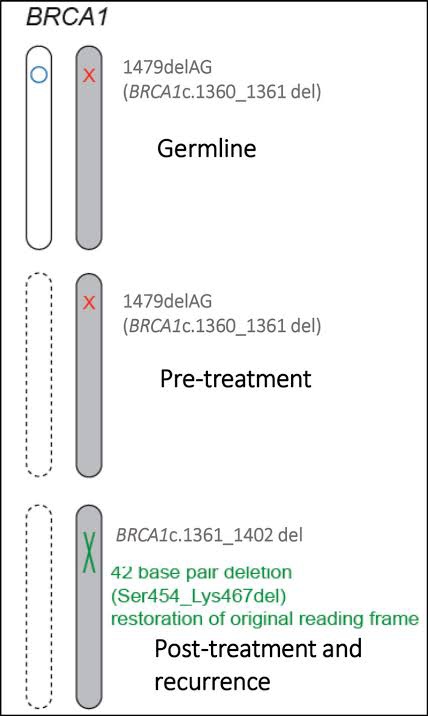
Existem vários mecanismos de resistência aos agentes inibidores da enzima PARP (poli ADP-ribose polimerase-1), incluindo o desenvolvimento de bombas de efluxo de drogas, perda ou mutação do sítio de ligação da proteína alvo da PARP e alterações nas enzimas envolvidas nos metabólitos à jusante da PARP, resultando em uma replicação irrestrita. Entretanto, um dos mais relevantes mecanismos é, sem dúvida, a chamada mutação de reversão no gene BRCA, que restaura a função BRCA anteriormente ausente e a capacidade das células de se auto-repararem através do mecanismo de recombinação homóloga.
Mutações de reversão foram descritas em vários estudos de câncer de ovário após a exposição das pacientes a terapias à base de platina e também de inibidores de PARP. Estas mutações são consideradas a causa mais comum de resistência aos inibidores de PARP e usualmente consistem em variações de nucleotídeo único (SNVs) ou deleções/inserções pontuais (indels) no gene BRCA, que por sua vez promovem mudanças na matriz de leitura próximas às mutações originais, isto é, um único nucleotídeo alterado modifica toda sequência de códons a partir da mutação resultando em um produto gênico completamente diferente do original. Essas mutações culminam na restauração da matriz de leitura dos genes BRCA 1 e 2, o que resulta na transcrição e na codificação (ou translação) da proteína original que produz o reparo do DNA à jusante, tornando assim as células tumorais resistentes tanto aos inibidores de PARP quanto à quimioterapia.
Estes eventos moleculares são, em geral, tardios nas populações celulares subclonais e podem ocorrer entre 15% a 70% dos cânceres de ovário após quimioterapia à base de platina ou tratamento com os inibidores de PARP, dependendo do tempo de exposição tumoral a estas drogas. Estudos recentes também identificam mutações de reversão no DNA tumoral circulante (ctDNA) em pacientes com câncer avançado de próstata e mama.
A detecção de mutações de reversão permite identificar aqueles pacientes que mais tarde irão progredir à terapia. De fato, as taxas de progressão no tratamento do câncer de ovário podem atingir até 33,3% em 36 meses com olaparibe e 50% em 12,8 meses com rucaparibe. Em um estudo de pacientes com câncer de ovário com mutação de BRCA, pacientes sem mutação de reversão de ctDNA detectada antes do início do rucaparibe tiveram uma sobrevida livre de progressão (PFS) mediana significativamente mais longa com o tratamento em comparação com aquelas pacientes que apresentaram mutações de reversão identificadas no ctDNA (9,0 vs 1,8 meses, respectivamente).
O uso de ctDNA seriado permite a detecção de mutações de resistência adquiridas ao longo do tempo, especialmente devido à inviabilidade clínica de se realizar várias amostragens tumorais por biópsias seriadas. Em alguns casos inclusive, a análise de ctDNA permitiu a detecção de mutações de reversão que não estavam presentes em amostras patológicas tumorais. Os modelos atuais de mutações de reversão se concentram em mutações individuais. No entanto, com o uso de análise de ctDNA para detecção de heterogeneidade tumoral (como o sequenciamento de célula única), foram descritas mutações de reversão multiclonais de resistência a inibidores de PARP em um mesmo indivíduo.