Os hematologistas Otávio Baiocchi (foto) e Adriana Penna, da UNIFESP e do Hospital Santa Catarina, em São Paulo, assinam artigo exclusivo sobre Linfoma de Hodgkin. Os autores destacam que o linfoma de Hodgkin é a doença linfoproliferativa com maior chance de cura em jovens e adultos, podendo ser curável em cerca de 80% dos casos.
{jathumbnail off}Introdução
*Otávio César Baiocchi e Adriana Marques Damasco Penna
 O linfoma de Hodgkin é uma neoplasia linfóide de origem linfocitária B descrita inicialmente em 1832 por Thomas Hodgkin, e definida histologicamente pelos patologistas Carl Sternberg e Dorothy Reed no começo do século 20. Segundo a Organização Mundial da Saúde (OMS), o linfoma de Hodgkin pode ser classificado em duas entidades (Quadro 1):
O linfoma de Hodgkin é uma neoplasia linfóide de origem linfocitária B descrita inicialmente em 1832 por Thomas Hodgkin, e definida histologicamente pelos patologistas Carl Sternberg e Dorothy Reed no começo do século 20. Segundo a Organização Mundial da Saúde (OMS), o linfoma de Hodgkin pode ser classificado em duas entidades (Quadro 1):
Quadro 1. Classificação do linfoma de Hodgkin.
Linfoma de Hodgkin predomínio linfocitário nodular |
| Linfoma de Hodgkin clássico (subtipos): |
| 1- Esclerose nodular |
| 2- Celularidade mista |
| 3- Rico em linfócitos |
| 4- Deplação linfocitária |
Fonte: Organização Mundial da Saúde (OMS), 2001.
O linfoma de Hodgkin clássico (LHc) compreende 4 subtipos: Esclerose nodular, celularidade mista, rico em linfócitos e depleção linfocítária e abrange um total de 95% dos casos diagnosticados de LH. O diagnóstico do LHc baseia-se no achado das células de Reed-Sternberg (RS), já o diagnóstico do LHPLN caracteriza-se pela presença de células linfóides grandes com membrana irregular chamadas de células de Hodgkin (em inglês também chamadas popcorn cells ou células em pipoca).
A incidência do LHc tem-se se mantido estável nas últimas décadas. Segundo dados da agência americana de estatística do câncer (SCA/NIH), estima-se que, no ano de 2013, 9.290 casos novos de LHc serão diagnosticados nos Estados Unidos e 1.180 mortes ocorrerão. A incidência é mais alta em homens e maior em caucasianos. A distribuição etária do linfoma de Hodgkin clássico é bimodal com grande pico na terceira década de vida e um outro pico após os 50 anos. O subtipo esclerose nodular é o mais comum, representando cerca de 65% de todos os casos de linfoma de Hodgkin clássico. O subtipo celularidade mista representa 25% dos casos. Os demais subtipos juntos representam cerca de 10% dos casos de LHc. Até o momento, não existem muitos dados epidemiológicos disponíveis para o LHPLN, provavelmente por ser uma entidade recentemente reconhecida pela classificação da OMS em 2001. A incidência do LHPLN parece ser igual maior no sexo masculino e mais comum na terceira e quarta décadas de vida.
Na década de 80, através da utilização dos métodos de hibridização in situ e imunohistoquímica, proteínas do vírus Epstein-Barr (EBV) foram identificadas nas células RS. Este achado, somado a evidências sorológicas e epidemiológicas, colocou o EBV como importante agente etiológico no surgimento do linfoma de Hodgkin clássico.
O EBV pode ser detectado nas células de RS em uma porcentagem variável dos casos de LHc, dependendo de fatores socioeconômicos e geográficos. No Brasil, o nosso grupo de estudos de linfoma de Hodgkin da UNIFESP mostrou uma taxa de prevalência do EBV nas células de RS de 85% em pacientes da Região Norte e de 44% em pacientes da cidade de São Paulo. O achado do EBV nas células de RS é mais comum em crianças e pré-adolescentes (< 15 anos) e em idosos (> 65 anos) e parece não guardar relação com o prognóstico destes pacientes.
Em imunossuprimidos infectados pelo virus da imunodeficiência adquirida (HIV) e na população pós-transplante, a incidência do LH EBV-relacionado é alta, podendo chegar a 90%. Pacientes imunossuprimidos de uma maneira geral possuem um risco relativo de 6 a 8 vezes maior de desenvolverem LHc quando comparados com a população normal, corroborando mais uma vez a idéia da imunossupressão como um ambiente propício para a proliferação desenfreada do EBV (4-5). Quando infecta as células RS, o EBV expressa três proteínas de membrana na superfície destas células: EBNA-1 (Epstein-Barr nuclear antigen 1),LMP-1 (latent membrane protein 1) e LMP-2 (latent membrane protein 2). Estas proteínas são importantes para o diagnóstico do LH EBV relacionado e para potenciais alvos terapêuticos.
Quadro clínico
O linfoma de Hodgkin clássico e o linfoma de Hodgkin predomínio linfocitário nodular possuem apresentação indolente. Geralmente, o paciente se queixa de um linfonodomegalia de crescimento lento e progressivo, e em dois terços dos casos têm apresentação cervical e intratorácica. Adenopatia mediastinal é bastante comum no linfoma de Hodgkin clássico, principalmente nas mulheres com o subtipo esclerose nodular. Caracteristicamente, os linfonodos não são dolorosos à palpação e apresentam consistência fibroelástica. O linfoma de Hodgkin raramente se apresenta com comprometimento extra-nodal, diferentemente dos linfomas não-Hodgkin, onde o acometimento de órgãos extra-nodais, tais como pele, ossos e trato gastrointestinal, é relativamente comum. Quando o acometimento extra-nodal acontece, o pulmão e o fígado são os dois órgãos mais comumente afetados pelo linfoma de Hodgkin, principalmente em idosos. O comprometimento da medula óssea ocorre em 5 a 20% dos pacientes jovens, e é mais comum em pacientes idosos e em estadio avançado, e naqueles com sinais e sintomas constitucionais.
Sinais e sintomas constitucionais, denominados sintomas B, podem acompanhar o diagnóstico do linfoma de Hodgkin e influenciam o prognóstico. Os sintomas B são:
· Febre≥37,8oC
· Sudorese noturna intensa
· Perda ponderal(> 10% do peso corporal basal durante os seis meses que antecedem o diagnóstico).
Em geral, a febre afeta cerca de um terço dos pacientes e se caracteriza por ser baixa e irregular. Raramente um padrão cíclico de febre alta por uma a duas semanas alterna com períodos afebris de duração semelhante; este fenômeno, quando presente, é patognomônico do linfoma de Hodgkin e recebe o nome de febre de Pel-Ebstein.
Uma outra queixa comum dos pacientes com linfoma de Hodgkin é o prurido generalizado inexplicado. Dor nos linfonodos imediatamente após o consumo de álcool também é um sinal peculiar e típico do linfoma de Hodgkin, porém raramente visto na prática clínica. A causa do prurido e da dor nos linfonodos após ingestão alcoólica ainda permanence obscura, mas parece estar relacionada às citocinas presentes e aumentadas no microambiente tumoral e no sangue periférico de pacientes com linfoma de Hodgkin.
Os achados laboratoriais do linfoma de Hodgkin são inespecíficos. O hemograma completo pode evidenciar leucocitose com predomínio de neutrófilos e eosinófilos ou leucopenia com linfocitopenia absoluta. Ambos os achados conferem pior prognóstico. Citopenias são consequência do envolvimento medular pelo linfoma ou, menos frequentemente, podem sugerir hiperesplenismo ou causa auto-imune. Um outro achado laboratorial comumente encontrado é a elevação da velocidade de hemossedimentação (VHS), estando relacionada à doença mais avançada e aos sinais e sintomas constitucionais.
ATENÇÃO – O linfoma de Hodgkin geralmente se apresenta com aumento ganglionar cervical e mediastinal de crescimento lento e indolor. Febre, sudorese noturna, perda de peso e prurido são sintomas comuns nos pacientes com linfoma de Hodgkin.
Diagnóstico
O linfoma de Hodgkin é uma neoplasia maligna composta principalmente por células inflamatórias (neutrófilos, eosinófilos, células NK além de linfócitos T e B), sendo que as células de RS e as células de Hodgkin perfazem apenas 1 a 5% de toda a massa tumoral.
O diagnóstico de linfoma de Hodgkin é feito por meio de biópsia excisional de linfonodo aumentado ou de área extranodal acometida. A punção aspirativa por agulha fina (PAAF) pode ser sugestiva de LH, mas não é suficiente para subclassificar a doença. A reação de imunohistoquímica é altamente recomendada para confirmação diagnóstica. As células de RS do LHc expressam CD15 e CD30, e apresentam negatividade para CD3, CD20 e CD45. No LHPLN as células de Hodgkin geralmente são CD45 e CD20 positivas, não expressam CD15 e raramente são positivas para o CD30. Confirmado o diagnóstico de LH, o próximo passo é proceder com o estadiamento do paciente.
O estadiamento é fundamental para o planejamento terapêutico do linfoma de Hodgkin (quadro 2) e tem como objetivo definir o número de sítios comprometidos, se há linfonodos envolvidos em um os dois lados do diafragma, se há grandes massas tumorais, também conhecidas como bulky, se há comprometimento extranodal e se há sintomas B. Para tanto, são necessários os seguintes procedimentos:
· História clínica e exame físico;
· Biópsia bilateral de medula óssea para definir infiltração pelo linfoma;
· Exames laboratoriais: hemograma completo, função hepática e renal, albumina, VHS e DHL (desidrogenase láctica), estes dois últimos usados como marcadores de atividade de doença;
· Tomografia de tórax, abdome e pelvecom contrasteou, quando disponível, o exame de PET-SCAN (escaneamento por emissão de pósitrons) ou PET-TC (associado à tomografia computadorizada)
Cabe ressaltar que, concomitante aos exames de estadiamento, outros exames são fundamentais na avaliação inicial dos pacientes com LH, tais como: Teste de gravidez (sempre deve ser realizado em mulheres em idade fértil). Tanto homens quanto mulheres em idade reprodutiva devem passar por uma avaliação com uma equipe multidisciplinar de fertilidade e reprodução humana; Prova de função pulmonar e Ecocardiograma transtorácico.
Após completo o estadiamento (Tabela 1), os pacientes com LHc são divididos em dois grupos:
· Linfoma de Hodgkin estadio localizado: estadio I ou II
· Linfoma de Hodgkin avançado: estadio III ou IV
Para os pacientes com LHc localizado, os principais fatores de mau prognóstico são (Quadro 3):
· Sintomas B
· Grande massa ganglionar ou massa bulky.Uma massa ganglionar é considerada bulky quando o diâmetro do seu maior eixo exceder 10cm (independente do seu local de acometimento), ou esta massa ocupar mais de 1/3 da cavidade torácica vista pela radiografia de tórax póstero-anterior (massa bulky mediastinal)
· Aumento de VHS(>30 para pacientes com sintomas B e >50 para pacientes sem sintomas B)
Para os pacientes com doença avançada sete fatores de mau prognóstico determinam o chamado IPS (International Prognostic Score) (Quadro 4). Para cada fator presente, uma redução de 7% a 8% na sobrevida global por ano é observada. São eles:
· Idade ≥ 45 anos
· Sexo masculino
· Estadio IV
· Albumina sérica < 4 g/dL
· Hemoglobina < 10,5 g/dL
· Leucocitose( > 15.000/mm3 leucócitos totais)
· Linfocitopenia(linfócitos < 8% do total de leucócitos e/ou contagem absoluta < 600/mm3 ).
ATENÇÃO: O estadiamento é fundamental para o planejamento terapêutico do linfoma de Hodgkin. Feito o estadiamento, os pacientes com linfoma de Hodgkin podem ser divididos em 02 grupos: Pacientes com doença localizada (estadio I e II); e pacientes com doença avançada (estadio III e IV).
Quadro 2. Estadiamento segundo Cotswolds
| Estadiamento | ||
| I | Envolvimento de uma região linfonodal única ou estrutura linfóide (baço, timo, anel de Waldeyer) | |
| II | Envolvimento ≥ 2 regiões linfonodais no mesmo lado do diafragma; número de sítios extra-nodais deve ser indicado por um sufixo;ex II3 | |
| III | Envolvimento de regiões linfonodais de estruturas em ambos os lados do diafragma. | |
| III1 | Com ou sem linfonodos portais, celíacos e hilar esplênico. | |
| III2 | Com nódulos mesentéricos, iliacos e para aórticos | |
| IV |
Envolvimento de sítios extra-nodais além dos designados em E Anotações: A = sem sintomas B B = com sintomas B (febre, sudorese noturna, perda de peso) X = doença “Bulky”= mediastino > 1/3 ou massa tumoral > 10cm E = Envolvimento extranodal único ou contíguo ou proximal à região nodal |
Além do estadiamento, os pacientes devem ser classificados de acordo com os fatores prognósticos descritos nos quadros 3 e 4. Estes fatores quantificam o risco de recidiva atribuído ao paciente.
Quadro 3. Fatores prognósticos em doença localizada (estádio I e II)
| Idade superior a 50 anos |
| VHS maior do que 50mm em pacientes assintomáticos |
| VHS maior do que 30mm em pacientes com sintomas B |
| Grande massa mediastinal |
| Doença localizada com mais de três regiões linfonodais acometidas |
Quadro 4. Fatores prognósticos em doença avançada (estádio III e IV)
| Albumina sérica <4g/dl |
| Hemoglobina < 10,5g/dl |
| Sexo Masculino |
| Idade > 45 anos |
| Leucócitos > 15.000/mm3 |
| Linfócitos < 600/mm3 ou < 8% |
TRATAMENTO
O linfoma de Hodgkin é a doença linfoproliferativa com maior chance de cura em jovens e adultos, podendo ser curável em cerca de 80% dos casos. Trata-se de uma neoplasia bastante sensível à quimioterapia e à radioterapia e o tipo e intensidade do tratamento depende, basicamente, do estadiamento obtido ao diagnóstico da doença. Assim, o tratamento do linfoma de Hodgkin clássico é direcionado para: pacientes com doença localizada e pacientes com doença avançada. Os esquemas atualmente utilizados para o tratamento do LHc são:
· ABVD (Adriamicina, Bleomicina, Vimblastina e Dacarbazina)
· Stanford V (Adriamicina, Vimblastina, Mechloretamina, Etoposide, Vincristina, Bleomicina e Prednisona)
· BEACOPP (Bleomicina, Etoposide, Adriamicina, Ciclofosfamida, Vincristina, Procarbazina e Prednisona)
É importante ressaltar que estes esquemas acima são igualmente eficazes. Os esquemas Stanford V e BEACOPP são mais mielotóxicos só devendo ser utilizados em situações especiais e de acordo com a experiência de cada instituição especializada no tratamento de pacientes com linfoma de Hodgkin. O esquema ABVD ainda é o esquema menos tóxico e mais utilizado no tratamento do LHc.
O tratamento radioterápico consiste na aplicação de 2400 a 3600 cGy em cada campo envolvido em doses fracionadas de 120 a 180 cGy. O efeitos colaterais e complicacões da radioterapia dependem do volume irradiado, dose irradiada, técnica empregada, tipo de quimioterapia prévia e idade do paciente. Resumidamente, o tratamento para o linfoma de Hodgkin clássico compreende:
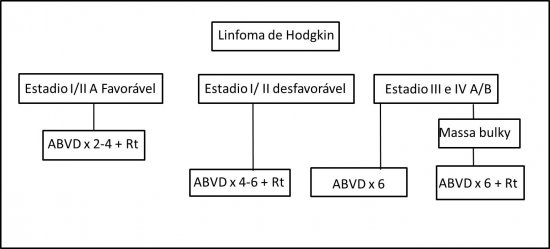
· Estadio IA e IIA (sem doença bulky): Quimioterapia com 4 ciclos de ABVD associada à Radioterapia de consolidação (2400 a 3000cGy)
· Estadio IB e IIB (sem doença bulky): Quimioterapia com 4 a 6 ciclos de ABVD ou Stanford V (8 semanas) associada à Radioterapia de consolidação (2400 a 3000cGy)
· Estadio I e II A ou B (com massa bulky): Quimioterapia com 6 ciclos de ABVD ou Stanford V (12 semanas) associada à Radioterapia de consolidação com (3000 a 3600 cGy).
· Estadio III e IVA ou B: Quimioterapia com 6 ciclos de ABVD ou Stanford V (12 semanas) ou BEACOPP associada ou não à Radioterapia. A Radioterapia está indicada nos casos de massa bulky.
Atualmente, o exame de PET-TC realizado após o segundo ciclo de ABVD (do inglês chamado de interin PET) tem grande importância prognóstica com impacto na sobrevida livre de doença de pacientes com LHc.
Quando o tratamento de primeira linha falha e o paciente apresenta linfoma de Hodgkin recidivado ou doença refratáriaa quimioterapia mieloablativa (quimioterapia de salvamento) com resgate de células tronco periféricas autólogas (transplante autólogo) tem sido a terapia de escolha nesta situação. Existem inúmeros esquema de salvamento que podem ser utilizados nesta situação, e a escolha deste esquema fica a critério da experiência do médico e da Instituição. Abaixo, estão listados alguns esquemas quimioterápicos de salvamento mais utilizados na prática clínica:
· ICE (Ifosfamida, Carboplatina e Etoposide)
· IGEV (Ifosfamida, Gemcitabina e Vinorelbine)
· DHAP (Dexametasona, Citarabina e Cisplatina)
· GDP (Gemcitabina, Dexametasona e Cisplatina)
O transplante de células tronco hemotopoéticas alogênico (aparentado e não aparentado) também é uma opção, porém os resultados obtidos até o momento mostram alta taxa de morbi-mortalidade. Recentemente, o uso de sangue de cordão umbilical como alternativa para o transplante alogênico e a utilização do transplante alogênico haplo-idêntico (quando existe compatibilidade parcial entre doador e receptor) têm merecido atenção especial, com resultados promissores.
Em 2011, a agência reguladora dos Estados Unidos (Food and Drug Administration, FDA) liberou a utilização de um anticorpo (anti-CD30 – Brentuximabe vedotin) nos casos de recidiva pós transplante autólogo ou em paciente que falharam a terapia de primeira linha e são inelegíveis para o transplante autólogo. O uso do Brentuximabe vedotin neste grupo de pacientes tem demonstrado resultados impressionantes; e a utlização desta droga no esquema de primeira linha (ABVD) já está sendo avaliada em estudos clínicos. Esta medicação já está liberada para comercialização no Brasil desde 2015.
O tratamento do linfoma de Hodgkin predomínio linfocitário nodular possui algumas peculiaridades que merecem atenção especial. Trata-se de uma neoplasia com taxas de cura muitas vezes superiores a 90%, porém com alta incidência de recidiva tardia.
As células de Hodgkin presentes neste tumor expressam o antígeno CD20, e, por conseguinte, podemos utilizar o anticorpo quimérico monoclonal anti-CD20 (Rituximabe) no tratamento deste linfoma. Diferente do linfoma de Hodgkin clássico, a radioterapia isolada (campo-envolvido) é muitas vezes indicada nos pacientes com doença localizada. Abaixo estão os esquemas de quimioterapia mais utilizados no LHPLN
· ABVD (Adriamicina, Bleomicina, Vimblastina e Dacarbazina) + Rituximabe
· CHOP (Ciclofosfamida, Adriamicina, Vincristina e Prednisona) + Rituximabe
· EPOCH (Ciclofosfamida, Adriamicina, Etoposide, Vincristina e Prednisona) + Rituximabe
· Rituximabe isolado
É importante ressaltar que estes esquemas acima são igualmente eficazes. O tratamento do LHPLN está condicionado ao estadio do paciente e à presença de sintomas B. Resumidamente, o tratamento do LHPLN compreende:
1) Estadio IA e IIA: Radioterapia campo envolvido isolada (3000 a 3600 cGy). O uso de imunoterapia com Rituximabe associado à quimioterapia convencional deve ser utilizado nos casos de recidivas.
2) Estadio IB e IIB: Embora extremamente rara na doença localizada, a presença de sintomas B exige a terapia combinada com quimioterapia associada ao Rituximabe e radioterapia de consolidação (3000 a 3400 cGy)
3) Estadio III e IVcom ou sem sintomas B: Quimioterapia convencional associada ao Rituximabe. A radioterapia está indicada apenas nos casos de massa bulky.
COMPLICAÇÕES DO TRATAMENTO
O tratamento do linfoma de Hodgkin está associado a vários efeitos colaterais agudos e crônicos. O tratamento das complicações agudas da quimioterapia e da irradiação é relativamente fácil, sobretudo com o advento da terapia anti-emética altamente efetiva. O mais preocupante são os efeitos do tratamento tardio incluindo outros processos malignos e cardiopulmonares.
Leucemias e linfomas não-Hodgkin foram observados cerca de 10 a 20 anos após o tratamento bem-sucedido do linfoma de Hodgkin, principalmente com esquemas de poliquimioterapia mais antigos que utilizavam dentre outros medicamentos a mostarda nitrogenada (Mechloretamina). Em um estudo realizado na Disciplina de Hematologia e Hemoterapia da Universidade Federal de São Paulo (Souza et al), o risco de neoplasia secundária está associado ao uso prévio de mostarda, como no esquema MOPP/ABV (Mechloretamina, Vincristina, Procarbazina, Prednisona. Adriamicina, Bleomicina e Vimblastina). O risco de leucemia aguda é significativamente menor após o uso difundido do esquema ABVD. Outros tipos de neoplasias, como a neoplasia de mama e pulmão, estão associadas à radioterapia, assim como o carcinoma basocelular e espinocelular de pele. Hipotireoidismo também é uma complicação frequente em pacientes que receberam radioterapia em região cervical.
Organograma de Tratamento de primeira linha para o LHc
Revisão
· O linfoma de Hodgkin é uma doença linfoproliferativa de origem B
· O linfoma de Hodgkin pode ser dividido em dois grupos: 1- Linfoma de Hodgkin clássico e 2- Linfoma de Hodgkin predomínio linfocitário nodular
· O linfoma de Hodgkin está relacionado ao vírus Epstein-Barr
· Geralmente se spresenta com linfonodomegalia de crescimento lento e progressivo
· Febre, sudorese noturna e perda de peso, denonimados sintomas B, podem estar presentes ao diagnóstico
· O diagnóstico do linfoma de Hodgkin é feito através de biópsia excisional do linfonodo ou área acometida
· O estadiamento é fundamental para o planejamento terapêutico do linfoma de Hodgkin
· O linfoma de hodgkin é a neoplasia linfóide mais curável nos jovens e adultos
· O linfoma de Hodgkin é bastante sensível a quimioterapia e radioterapia
*Autores: Otávio César Carvalho Guimarães Baiocchi - Possui graduação em Medicina pela Universidade Federal de Goiás. Doutorado em Medicina (Hematologia) pela Universidade Federal de São Paulo - UNIFESP. Pós-Doutorado na Universidade Johns Hopkins. Atualmente é Professor Adjunto e Chefe do Departamento de Oncologia clínica e experimental da Universidade Federal de São Paulo - UNIFESP, Membro do comitê cientifico do Registro Brasileiro de Linfoma de Hodgkin, Coordenador no Núcleo Educativo Assistencial em Oncologia (NEA-Onco), Coordenador do ambulatório de linfomas da UNIFESP e médico da equipe de hematologia do Hospital Santa Catarina.
Adriana Marques Damasco Penna
Doutora em medicina pela Universidade federal de São Paulo - UNIFESP. Possui graduação em Medicina pela Universidade de Santo Amaro, especialização em Clinica Médica pela Universidade de Santo Amaro e em Hematologia e Hemoterapia pela Casa de Saúde Santa Marcelina. É professora da Disciplina de Hematologia e Hemoterapia do Centro Universitário São Camilo e médica hematologista do ambulatório de linfomas da UNIFESP e da equipe de hematologia do Hospital Santa Catarina.
Referências Bibliográficas
1. Canellos GP, et al. Chemotherapy of Advanced Hodgkin’s Disease with MOPP, ABVD, or MOPP Alternating with ABVD. NEJM 1992;327:1478-84
2. Cerci JJ, et al. 18FDG PET after 2 cycles of ABVD predicts event-free survival in early and advanced Hodgkin lymphoma. J Nucl Med. 2010; 51 (9): 1337-1343.
3. Diehl V, et al. Standard and increased-dose BEACOPP chemotherapy compared with COPP-ABVD for advanced Hodgkin’s disease.N Engl J Med 2003 Jun 2;348(24):2386-95.
4. Diehl V, Thomas RK, Re D. Part II: Hodgkin’s lymphoma – diagnosis and treatment. Lancet Oncol. 2004; 5:19-26.
5. El-Galaly TC, et al. Positron emission tomography/computed tomography surveillance in patients with Hodgkin lymphoma in first remission has a low positive predictive value and high costs. Haematologica. 2012 Jun;97(6):931-6.
6. Hasenclever D, Diehl V. A prognostic score for advanced Hodgkin’s disease. International Prognostic Factors Project on advanced Hodgkin’s Disease. N Engl J Med. 1998;339:1506-1514.
7. Lister TA, Crowther D, Sutcliffe SB, Glatstein E, Canellos GP, Young RC, et al. Report of a committee convened to discuss the evaluation and staging of patients with Hodgkin’s disease: Cotswolds meeting. J Clin Oncol. 1989; 7: 1630-1636
8. Patel V, et al. Computed tomography and positron emission tomography/computed tomography surveillance after combined modality treatment of supradiaphragmatic Hodgkin lymphoma: a clinical and economic perspective. Leuk Lymphoma. 2013 Oct;54(10):2168-76
9. Sarina B, et al. Allogeneic transplantation improves the overall and progression-free survival of Hodgkin lymphoma patients relapsing after autologous transplantation: a retrospective study based on the time of HLA typing and donor availability. Blood. 2010;115:3671-77.
10. Stein H. Hodgkin lymphoma. In: Swerdlow EH, Campo E, Harris NL, Jaffe ES, Pileri SA, Stein H,Thiele J, Vardimam JW (eds). World Health Organization Classification of Tumours of Haematopoietic and Lymphoid Tissues. IARC Press: Lyon. 2008:321-334.
11. Younes A, et al. Brentuximab vedotin (SGN-35) for relapsed CD30-positive lymphomas. N Engl J Med. 2010 Nov 4;363(19):1812-21.
12. Souza EM, Baiocchi OC, Zanichelli MA, et al. Impact of Epstein-Barr virus in the clinical evolution of patients with classical Hodgkin's lymphoma in Brazil. HematolOncol.2010;28(3):137.




