 Em artigo exclusivo, as oncologistas Mirela Souto (foto) e Eldsamira Mascarenhas, do Núcleo de Oncologia da Bahia (NOB) e do Hospital Português, abordam o cenário atual do tratamento da neoplasia esôfago-gástrica. O ramucirumabe, anticorpo monoclonal anti-VEGF-2 ainda não aprovado no Brasil, mostrou eficácia no tratamento do câncer gástrico em estudos fase III que culminaram na sua aprovação em 2ª linha pelo FDA.
Em artigo exclusivo, as oncologistas Mirela Souto (foto) e Eldsamira Mascarenhas, do Núcleo de Oncologia da Bahia (NOB) e do Hospital Português, abordam o cenário atual do tratamento da neoplasia esôfago-gástrica. O ramucirumabe, anticorpo monoclonal anti-VEGF-2 ainda não aprovado no Brasil, mostrou eficácia no tratamento do câncer gástrico em estudos fase III que culminaram na sua aprovação em 2ª linha pelo FDA.
{jathumbnail off}Por Mirela Souto e Eldsamira Mascarenhas*
INTRODUÇÃO
O câncer gástrico é a 5ª neoplasia mais comum e responsável pela 3ª causa de morte por câncer em todo mundo. Atualmente, é uma das neoplasias que mais cresce em incidência nos Estados Unidos, fato atribuído à alta prevalência da obesidade e refluxo gastro-esofágico na população norte-americana. Infelizmente, cerca de 50% dos pacientes apresentam doença avançada ao diagnóstico e menos de 30% estarão vivos em 5 anos1.Apesar do surgimento de novas possibilidades terapêuticas nos últimos anos, o impacto na sobrevida global foi modesto, principalmente na população oriental. Estima-se que, em 2016, 20.520 novos casos serão diagnosticados no Brasil2. Infelizmente, a maior parte dos pacientes é diagnosticada com doença já avançada e o tratamento é instituído com intuito puramente paliativo.
Até a década de 1980, quando a histologia escamosa representava a maior parte das neoplasias esôfago-gástricas, os regimes quimioterápicos mais utilizados eram baseados em cisplatina e fluoropirimidina, em analogia aos tumores de cabeça e pescoço. A partir dos anos 90, o adenocarcinoma passou a ser a histologia predominante e a adição de antraciclinas à cisplatina e 5-fluoruracil mostrou superioridade. O regime baseado em 3 drogas passou, então, a ser o tratamento standard para doença inicial3.
No cenário da doença avançada, metanálise demonstrou benefício em sobrevida global do tratamento quimioterápico em comparação a suporte clínico exclusivo4.Não existe, no entanto, regime padrão de 1ª linha. O estudo REAL demonstrou que EOX (epirrubicina, oxaliplatina e capecitabina) é uma opção tão eficaz quanto ECF (epirrubicina, oxaliplatina e 5-fluoruracil) e com melhor perfil de toxicidade5.O esquema DCF (docetaxel, cisplatina e 5-fluoruracil), mostrou-se superior ao mesmo esquema sem taxano, tanto em taxas de resposta como em sobrevida em 2 anos. No entanto, diante do perfil de toxicidade do regime, uma pequena parcela dos pacientes consegue ser submetida a esse esquema6.
Apesar da terapia combinada promover maiores taxas de resposta, o impacto em sobrevida livre de progressão e sobrevida global é menor. Dessa forma, para pacientes com condição clínica limitada, devemos priorizar agentes únicos ou paliação de sintomas apenas.
A hiperexpressão de HER-2, presente em cerca de 7 a 22% desses tumores, deve ser sempre pesquisada. O estudo ToGA demonstrou benefício de mais de 2 meses em sobrevida global com a adição do trastuzumabe à cisplatina e 5-fluoruracil, além de maiores taxas de resposta, com maior impacto nos tumores com imunohistoquímica 3+ para hiperexpressão da proteína7.Estudo com duplo bloqueio de HER-2 com pertuzumabe e trastuzumabe encontra-se em andamento8.
FATORES ANTI-VEGF
A importância dos fatores de crescimento endotelial vascular (VEGF) já está bem estabelecida no processo de carcinogênese. O VEGF-A é o mais amplamente estudado e atua de forma crucial na angiogênese, ativando dois receptores de tirosina-quinases, o VEGFR1 e VEGFR2. Acredita-se que esteja anormalmente expressso na vasta maioria dos tumores e que exista uma íntima relação entre sua superexpressão e um pior prognóstico. O VEGFR1 é um receptor transmembrana que estimula a formação de novos vasos, e o VEGFR2 regula a migração de células endoteliais através de vias de sinalização intracelular (figura 1)9. Ambos os receptores estão presentes tanto na superfície endotelial como no interior das células tumorais.
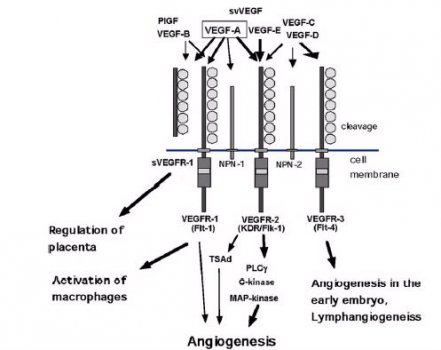 Figura 1
Figura 1
O estudo fase III AVAGAST não demonstrou benefício do bevacizumabe em adição à cisplatina e capecitabina, a despeito dos resultados promissores no fase II quando combinado com irinotecano e cisplatina. O estudo não atingiu seu end point primário, sobrevida global, apesar do aumento nas taxas de resposta e sobrevida livre de progressão10.
O ramucirumabe é um anticorpo monoclonal IgG1 totalmente humanizado que age no receptor de VEGF tipo 2, bloqueando sua ativação. Consequentemente, ocorre uma redução no processo de neovascularização e crescimento tumoral11. A droga já está aprovada em alguns países para câncer da transição gastro-esofágica, colorretal e de pulmão não-pequenas células. Os principais estudos que avaliaram a eficácia do anticorpo nesses dois cenários serão abordados a seguir.
EFICÁCIA NO CÂNCER ESÔFAGO-GÁSTRICO
Estima-se que 50% das neoplasias gástricas expressem VEGF e que tumores que exibam maior expressão de VEGFA apresentem um pior prognóstico11.
O ramucirumabe foi o primeiro agente antiangiogênico a demonstrar um benefício em sobrevida global e sobrevida livre de progressão em pacientes com câncer gastroesofágico metastático. Os estudos RAINBOW e REGARD levaram a aprovação da droga em 2ª linha pelo FDA nos Estados Unidos.
O REGARD12, estudo fase III placebo-controlado, avaliou pacientes com adenocarcinoma da junção gastroesofágica que progrediram à terapia de 1ª linha baseada em platina. Os pacientes foram randomizados para receberem ramucirumabe 8mg/kg ou placebo a cada 2 semanas, até progressão de doença ou toxicidade inaceitável. Um aumento de 1,4 mês foi observado no grupo que recebeu o anticorpo em relação ao placebo (5,2 x 3,8 meses; p= 0,047). Houve também um aumento em sobrevida livre de progressão de 1,3 para 2,1 meses (HR= 0,48; p< 0,0001), porém sem diferença nas taxas de resposta (ao redor de 3%). Apesar do benefício ser consistente com o demonstrado em outros estudos de 2ª linha com quimioterapia, o perfil de toxicidade do anticorpo é muito melhor tolerado.
O ramucirumabe também foi avaliado como terapia de segunda linha em pacientes portadores de adenocarcinoma da junção gastro-esofágica no estudo RAINBOW13. Um total de 665 pacientes foram randomizados, em uma proporção 1:1, para receberem paclitaxel 80mg/m2 no D1, D8 e D15 a cada 4 semanas com placebo ou ramucirumabe 8mg/kg no D1 e D15 a cada 4 semanas ate progressão de doença ou toxicidade inaceitável. O objetivo primário do estudo foi sobrevida global e foi significativamente maior no grupo experimental em relação ao placebo (9,6 x 7,4 meses, HR=0,80; p= 0.017). Taxas de resposta e sobrevida livre de progressão (4,4 x 2,9 meses, HR= 0,63, p<0,0001) também foram maiores no grupo que recebeu o anticorpo. Resposta objetiva foi observada em 28% dos pacientes do grupo experimental e em 16% do controle.
É importante ressaltar que, apesar desses dois estudos não poderem ser diretamente comparados, a maior sobrevida média global vista no RAINBOW pode ser decorrente das diferenças nos tratamentos prévios, já que os pacientes do REGARD foram expostos a regimes mais intensos em 1ª linha. Novos estudos deverão avaliar os subgrupos de pacientes que mais se beneficiam da medicação, de acordo com biomarcadores preditivos de maior resposta.
No cenário de 1ª linha, estudo fase II não demonstrou ganho estatisticamente significativo em sobrevida livre de progressão e sobrevida global na adição do Ramucirumabe ao regime FOLFOX14.
Atualmente, o estudo RAINFALL15 encontra-se em fase de recrutamento e avaliará a combinação do ramucirumabe à quimioterapia em 1ª linha nessa mesma população de pacientes. O braço experimental consiste no anticorpo na dose de 8mg/kg no D1 e D8, cisplatina 80mg/m2 no D1 e capecitabina 1000mg/m2 a cada 12 horas diariamente por 14 dias, a cada 3 semanas. O braço controle receberá o mesmo regime quimioterápico, sem o ramucirumabe. O objetivo primário do estudo é sobrevida livre de progressão.
EFICÁCIA NO CÂNCER DE PULMÃO
O ramucirumabe, em combinação com o docetaxel, foi aprovado em 2ª linha para pacientes com neoplasia de pulmão não-pequenas células metastático, após a publicação do estudo fase III REVEL16. Um total de 1253 pacientes com histologia escamosa e adenocarcinoma que progrediram após 1ª linha baseada em platina foram randomizados para docetaxel 75mg/m2 com ou sem ramucirumabe 10mg/kg a cada 3 semanas, ate progressão de doença ou intolerância ao tratamento. O benefício em sobrevida global foi modesto, porém estatisticamente significante: 10,5 x 9,1 meses a favor do grupo experimental (HR= 0,86; p= 0,023). Houve também benefício em sobrevida livre de progressão, de 3,0 para 4,5 meses (HR= 0,76; p<0,0001).
EFICÁCIA NO CÂNCER COLORETAL
Baseado no estudo fase III RAISE17, o ramucirumabe foi aprovado pelo FDA para pacientes portadores de neoplasia colorretal metastática refratária ao tratamento de 1ª linha baseado em fluoropirimidina, bevacizumabe e oxaliplatina. Pacientes que progrediram após esse regime e que apresentavam mutação do KRAS foram randomizados para FOLFIRI com ou sem ramucirumabe 8mg/kg a cada 2 semanas. A sobrevida média global foi de 13,3 meses para o grupo que recebeu o antiangiogênico e 11,7 para o grupo de quimioterapia apenas (HR= 0,84; p= 0,02). Apesar desses resultados, a indicação do ramucirumabe em 2ª linha ainda é bastante questionável, diante de estudos clássicos que indicam o benefício da manutenção do bevacizumabe após progressão, trocando-se apenas o regime quimioterápico.
PRINCIPAIS EFEITOS ADVERSOS
O ramucirumabe é uma medicação geralmente bem tolerada. No estudo REGARD os efeitos adversos grau 3 mais comuns, apesar de raros, foram hipertensão, dor abdominal e tromboembolismo arterial. Perfuração gastrointestinal foi reportada em menos de 1% dos pacientes. Cerca de 8% dos pacientes apresentarão hipertensão arterial severa. Em casos de encefalopatia hipertensiva ou falta de controle da pressão arterial a despeito de tratamento medicamentoso, a droga deve ser descontinuada permanentemente. Proteinúria pode ocorrer em 8% dos pacientes. Síndrome de leucoencefalopatia posterior reversível já foi reportada e deve ser suspeitada caso o paciente apresente sintomas como cefaleia, letargia, confusão mental ou distúrbios visuais12,18.
CONSIDERAÇÕES FINAIS
Nos últimos anos, os estudos relacionados às vias de sinalização que envolvem fatores de crescimento vascular revelaram que o processo de angiogênese assume importante papel na carcinogênese de diversos tumores sólidos. O ramucirumabe, anticorpo monoclonal contra o VEGF-2, mostrou eficácia no tratamento do câncer gástrico em estudos fase III que culminaram na sua aprovação em 2ª linha pelo FDA.
O perfil de toxicidade da droga é semelhante a outros antiangiogênicos, com boa tolerância. Apesar dos estudos fase III acima descritos demonstrarem benefício do ramucirumabe em 2ª linha em pacientes com adenocarcinoma da transição gastro-esofágica, colorretal e não-pequenas células de pulmão, a droga ainda não está aprovada no Brasil. Infelizmente, a carência na incorporação de novas drogas é uma realidade no nosso país e representa uma grande limitação para o avanço do tratamento oncológico. No entanto, novos estudos devem ser conduzidos visando um melhor entendimento da atuação do ramucirumabe em 1ª linha com outros regimes ainda não estudados, bem como de biomarcadores que selecionem pacientes que apresentem melhor resposta à droga.
*Autoras: Mirela Souto e Eldsamira Mascarenhas são oncologistas clínicas do Núcleo de Oncologia da Bahia e do Hospital Português
REFERÊNCIAS:
1. SEER Cancer Statistics http://www.seer.cancer.gov/statistics
2. www.inca.gov.br
3. Devesa SS, Blot WJ, Fraumeni JF Jr. Changing patterns in the incidence of esophageal and gastric carcinoma in the United States. Cancer. 1998 Nov 15;83(10):2049-53
4. Glimelius B, Ekström K, Hoffman K, Graf W, Sjödén PO, Haglund U, Svensson C, Enander LK, Linné T, Sellström H, Heuman R. Randomized comparison between chemotherapy plus best supportive care with best supportive care in advanced gastric cancer. Ann Oncol. 1997 Feb;8(2):163-8.
5. Cunningham D, Starling N, Rao S, Iveson T, Nicolson M, Coxon F, Middleton G, Daniel F, Oates J, Norman AR; Upper Gastrointestinal Clinical Studies Group of the National Cancer Research Institute of the United Kingdom. Capecitabine and oxaliplatin for advanced esophagogastric cancer. N Engl J Med. 2008 Jan 3;358(1):36-46
6. Van Cutsem E, Moiseyenko VM, Tjulandin S, Majlis A, Constenla M, Boni C, Rodrigues A, Fodor M, Chao Y, Voznyi E, Risse ML, Ajani JA; V325 Study Group. Phase III study of docetaxel and cisplatin plus fluorouracil compared with cisplatin and fluorouracil as first-line therapy for advanced gastric cancer: a report of the V325 Study Group. J Clin Oncol. 2006 Nov 1;24(31):4991-7
7. Bang YJ, Van Cutsem E, Feyereislova A, Chung HC, Shen L, Sawaki A, Lordick F, Ohtsu A, Omuro Y, Satoh T, Aprile G, Kulikov E, Hill J, Lehle M, Rüschoff J, Kang YK. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet. 2010 Aug 28;376(9742):687-97
8. https://clinicaltrials.gov/ct2/show/NCT01774786
9. Satolli MA, Buffoni L, Spadi R, Roato I. Gastric cancer: The times they are a-changin. World J Gastrointest Oncol. 2015 Nov 15;7(11):303-16
10. Ohtsu A, Shah MA, Van Cutsem E, Rha SY, Sawaki A, Park SR, Lim HY, Yamada Y, Wu J, Langer B, Starnawski M, Kang YK. Bevacizumab in combination with chemotherapy as first-line therapy in advanced gastric cancer: a randomized, double-blind, placebo-controlled phase III study. J Clin Oncol. 2011 Oct 20;29(30):3968-76.
11. Young K, Smyth E, Chau I. Ramucirumab for advanced gastric cancer or gastro-esophageal junction adenocarcinoma. Therap Adv Gastroenterol. 2015 Nov;8(6):373-83
12. Fuchs CS, Tomasek J, Yong CJ, Dumitru F, Passalacqua R, Goswami C, Safran H, dos Santos LV, Aprile G, Ferry DR, Melichar B, Tehfe M, Topuzov E, Zalcberg JR, Chau I, Campbell W, Sivanandan C, Pikiel J, Koshiji M, Hsu Y, Liepa AM, Gao L, Schwartz JD, Tabernero J. Ramucirumab monotherapy for previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (REGARD): an international, randomised, multicentre, placebo-controlled, phase 3 trial. Lancet. 2014 Jan 4;383(9911):31-9
13. Wilke H, Muro K, Van Cutsem E, Oh SC, Bodoky G, Shimada Y, Hironaka S, Sugimoto N, Lipatov O, Kim TY, Cunningham D, Rougier P, Komatsu Y, Ajani J, Emig M, Carlesi R, Ferry D, Chandrawansa K, Schwartz JD, Ohtsu A; RAINBOW Study Group. Ramucirumab plus paclitaxel versus placebo plus paclitaxel in patients with previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (RAINBOW): a double-blind, randomised phase 3 trial. Lancet Oncol. 2014 Oct;15(11):1224-35
14. Zhang Y, Wu S. Novel therapy for advanced gastric cancer. World J Gastrointest Oncol. 2015 Nov 15;7(11):263-70
15. https://clinicaltrials.gov/ct2/show/NCT02314117.
16. Garon EB, Ciuleanu TE, Arrieta O, Prabhash K, Syrigos KN, Goksel T, Park K, Gorbunova V, Kowalyszyn RD, Pikiel J, Czyzewicz G, Orlov SV, Lewanski CR, Thomas M, Bidoli P, Dakhil S, Gans S, Kim JH, Grigorescu A, Karaseva N, Reck M, Cappuzzo F, Alexandris E, Sashegyi A, Yurasov S, Pérol M. Ramucirumab plus docetaxel versus placebo plus docetaxel for second-line treatment of stage IV non-small-cell lung cancer after disease progression on platinum-based therapy (REVEL): a multicentre, double-blind, randomised phase 3 trial. Lancet. 2014 Aug 23;384(9944):665-73.
17. Tabernero J, Yoshino T, Cohn AL, Obermannova R, Bodoky G, Garcia-Carbonero R, Ciuleanu TE, Portnoy DC, Van Cutsem E, Grothey A, Prausová J, Garcia-Alfonso P, Yamazaki K, Clingan PR, Lonardi S, Kim TW, Simms L, Chang SC, Nasroulah F; RAISE Study Investigators. Ramucirumab versus placebo in combination with second-line FOLFIRI in patients with metastatic colorectal carcinoma that progressed during or after first-line therapy with bevacizumab, oxaliplatin, and a fluoropyrimidine (RAISE): a randomised, double-blind, multicentre, phase 3 study. Lancet Oncol. 2015 May;16(5):499-508.
18. ElHalawani H, Abdel-Rahman O. Critical evaluation of ramucirumab in the treatment of advanced gastric and gastroesophageal cancers. Ther Clin Risk Manag. 2015 Jul 28;11:1123-32




