 O regime triplet com acalabrutinibe, venetoclax e obinutuzumabe (AVO) é altamente ativo e bem tolerado em uma população com leucemia linfocítica crônica (LLC) enriquecida para doença de alto risco, com 83% dos pacientes TP53-aberrantes alcançando doença residual mínima indetectável na medula óssea (BM-uMRD) após 15 meses de tratamento. Os resultados são de estudo apresentado por Christine E. Ryan (foto) do Dana-Farber Cancer Institute, no ASH 2022.
O regime triplet com acalabrutinibe, venetoclax e obinutuzumabe (AVO) é altamente ativo e bem tolerado em uma população com leucemia linfocítica crônica (LLC) enriquecida para doença de alto risco, com 83% dos pacientes TP53-aberrantes alcançando doença residual mínima indetectável na medula óssea (BM-uMRD) após 15 meses de tratamento. Os resultados são de estudo apresentado por Christine E. Ryan (foto) do Dana-Farber Cancer Institute, no ASH 2022.
Embora venetoclax (V) mais obinutuzumabe (O) seja um regime frontline altamente eficaz em pacientes com LLC, os resultados permanecem abaixo do ideal para pacientes de alto risco. A eficácia de ibrutinibe mais VO nesses pacientes é encorajadora, mas toxicidades cardíacas e infecciosas são comuns.
A hipótese dos pesquisadores é que um triplet de tempo limitado com o BTKi seletivo acalabrutinibe (A) seria ativo e bem tolerado. Os autores publicaram anteriormente os resultados de uma coorte inicial irrestrita por risco genético (Davids et al., 2021), e agora relatam uma nova coorte com recrutamento restrito a pacientes de alto risco, bem como um acompanhamento mais longo da coorte inicial.
Nesse estudo de Fase 2 foram inscritos inicialmente pacientes virgens de tratamento com LLC com qualquer perfil de risco genético (coorte 1), seguido por uma expansão multicêntrica restrita a pacientes sem tratamento prévio com LLC TP53-aberrante (coorte 2). Os pacientes iniciaram o tratamento em 100 mg BID por 28 dias, seguido por 2 ciclos de AO (O na dosagem padrão); a administração de venetoclax teve início no ciclo 4 (C4D1) a 20 mg, depois 50 mg em C4D2, com aumento semanal a partir de então para 400 mg QD (total 4 semanas V ramp-up).
O regime triplet AVO continua entre os ciclos 5 e 7 (C5-7; 6 ciclos totais de O) e acalabrutinibe e venetoclax (AV) permanecem sendo administrado entre os ciclos 8 e 15 (C8-15). Se o desfecho primário de remissão completa (CR) com doença residual mínima na medula óssea indetectável (BM-uMRD) for alcançado no dia 1 do ciclo 16 (C16D1), os pacientes podem descontinuar a terapia; todos os outros continuam o doublet AV até o ciclo 24 (C24), com a opção de descontinuar se BM-uMRD no dia 1 do ciclo 25 (C25D1).
Foram avaliados a eficácia pelos critérios iwCLL (2018), toxicidades por CTCAE v5, MRD por fluxo central de 8 cores (sensibilidade 10-4) e NGS clonoSEQ (sensibilidade de até 10-6, adaptável). O trabalho de perfilagem de BH3 está em andamento, realizado conforme descrito anteriormente (Ryan J et al., 2016) em amostras de sangue periférico (PB) após 1 e 3 ciclos. A associação da dependência de BCL-2 com a resposta clínica foi comparada por um teste t não pareado.
Resultados
Em 13 de julho de 2022, 68 pacientes foram incluídos (coorte 1 all-comers: n = 37, coorte 2 TP53-aberrante: n = 31) neste estudo em andamento (NCT03580928), com acompanhamento médio de 35 meses (intervalo 2 -45). Em todos os 68 pacientes, a mediana de idade foi 63 anos (intervalo 36-80); 25% ≥70 anos; 66% masculino; 60% TP53-aberrante (del(17p) ou mut); 24% cariótipo complexo (≥3 anormalidades); 74% IGHV não mutado.
Dos 56 pacientes avaliáveis até o momento em C16D1, 43% (24/56) atingiram o endpoint primário BM-uMRD CR. A melhor ORR foi de 98% (48% CR, 50% PR). Em C16D1, MRD por fluxo: 86% PB-uMRD, 86% BM-uMRD (Fig. 1A). Em um subconjunto de 49 pacientes com amostras disponíveis, 59% eram PB-uMRD por NGS com sensibilidade de 10-5 (em 10-6, 59% dos pacientes tiveram resultados indeterminados devido a baixas contagens de células).
Nos 29 pacientes com doença aberrante TP53 avaliável no dia 1 do ciclo 16 (C16D1), a melhor ORR foi 100% (52% CR, 48% PR) e 45% (13/29) alcançou BM-uMRD CR, MRD por fluxo: 86% PB -uMRD, 83% BM-uMRD (Fig. 1A). Não houve diferenças na resposta ou MRD com base no status IGHV. 79% (19/24) dos pacientes em BM-uMRD CR descontinuaram eletivamente o tratamento após 15 ciclos; o tempo médio de folga do tratamento para esses pacientes é de 22,9 meses (intervalo de 1 a 30). 2 dos 19 pacientes que descontinuaram o tratamento tiveram apenas recorrência de doença residual mínima e 1 teve progressão da doença; todos os 3 reiniciaram o tratamento com AV e alcançaram remissão parcial (PR).
Três pacientes desenvolveram a síndrome de Richter: 1 com DLBCL após 15 meses no estudo e 2 com transformação de Hodgkin (um 13 meses após concluir o tratamento do estudo e um 12 meses no tratamento do estudo; ambos atingiram remissão completa para tratamento dirigido por Hodgkin). 93% de todos os pacientes (63/68) permanecem livres de progressão.
Em todos os 68 pacientes, toxicidade heme de todos os graus incluiu neutropenia (75%; 37% Gr3/4), trombocitopenia (73%; 28% Gr3/4), anemia (49%, 3% Gr3). Tox não-heme: dor de cabeça (78%, 1% Gr3), fadiga (76%, 1% Gr3), hematomas (66%, todos Gr1/2), náusea (49%, todos Gr1/2), diarreia (40 %, 4% Gr3), reação relacionada à infusão (30%, 4% Gr3), hipertensão (27%; 9% Gr3), aumento de ALT (27%, 1% Gr3), artralgia (25%, todos Gr1), e infecção (6% Gr3; 1 caso de pneumonia Gr5 COVID-19). 2,9% (2/68) pacientes tinham fibrilação atrial. 14 pacientes (21%) necessitaram de redução da dose de apenas acalabrutinibe (4%), apenas venetoclax (9%) ou ambas as drogas (7%).
O perfil de BH3 está em andamento e os dados iniciais sugerem que os pacientes que mais tarde alcançaram remissão completa podem ter um aumento maior na dependência de BCL-2 em C4D1 do que os pacientes que atingiram remissão parcial como melhor resposta (p = 0,05, Fig. 1B).
Em síntese, AVO demonstrou ser um regime triplet altamente ativo e bem tolerado em uma população LLC frontline enriquecida para doença de alto risco, com 83% dos pacientes TP53-aberrantes alcançando doença residual mínima da medula óssea indetectável (BM-uMRD) após 15 meses de tratamento. “As respostas são duradouras, com 93% de sobrevida livre de progressão em todos os pacientes em um acompanhamento médio de quase 3 anos. Foram observadas baixas taxas de toxicidade cardíaca e infecciosa. Nossos dados apoiam a investigação contínua do triplet AVO por tempo limitado e guiado por doença residual mínima”, concluíram os autores.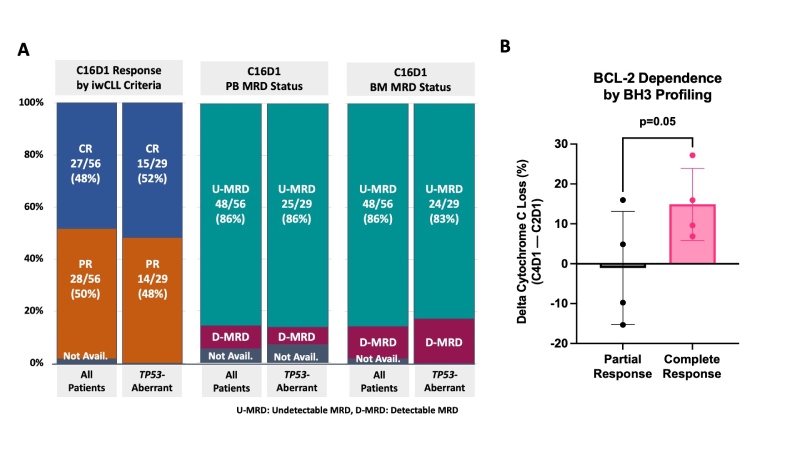 Referência: 344 Updated Results from a Multicenter, Phase 2 Study of Acalabrutinib, Venetoclax, Obinutuzumab (AVO) in a Population of Previously Untreated Patients with CLL Enriched for High-Risk Disease
Referência: 344 Updated Results from a Multicenter, Phase 2 Study of Acalabrutinib, Venetoclax, Obinutuzumab (AVO) in a Population of Previously Untreated Patients with CLL Enriched for High-Risk Disease
Program: Oral and Poster Abstracts
Type: Oral
Session: 642. Chronic Lymphocytic Leukemia: Clinical and Epidemiological: Targeted Triplet Combinations and Richter’s Transformation
Saturday, December 10, 2022: 4:15 PM
Christine E. Ryan et al




