Bottom-Line
A terapia endoscópica na doença precoce de esôfago deve sempre ser utilizada em uma lesão esofágica superficial, seja um carcinoma espinocelular (CEC) com NBI-ME (do inglês, narrow band imaging – magnifying endoscopy) padrão B1 ou B2 ou em uma área de esôfago de Barrett com displasia ou adenocarcinoma superficial. Sempre que possível é indicado a Endoscopic Submucosal Dissection (ESD). Se for inviável, outras técnicas de ressecção (EMR ou EPMR) podem ser utilizadas, complementadas por técnicas de ablação, quando necessário. No momento, pacientes mais jovens ou com oncogênese de campo bem evidente têm recebido o tratamento mais agressivo, quer seja pela agressividade da replicação celular ou pela possibilidade de desenvolver lesões multicêntricas.
Marcelo Simas de Lima (foto) é cirurgião do aparelho digestivo e endoscopista. Atua no Instituto do Câncer do Estado de São Paulo (ICESP), na BP Diagnósticos, da Beneficência Portuguesa de São Paulo e no Hospital Alemão Oswaldo Cruz.
Marcelo Simas de Lima1 e Fauze Maluf Filho2
- Cirurgião do aparelho digestivo e endoscopista. Atua no Instituto do Câncer do Estado de São Paulo (ICESP), na BP Diagnósticos, da Beneficência Portuguesa de São Paulo e no Hospital Alemão Oswaldo Cruz.
- Endoscopista e livre docente da Faculdade de Medicina da Universidade de São Paulo. Chefe do serviço de endoscopia digestiva do ICESP. Editor associado da revista Gastrointestinal Endoscopy.
Resumo
Neste artigo, os autores discutem quando, como e para quem a terapia endoscópica deve ser adotada no câncer de esôfago inicial e em lesões precursoras. Os cânceres de esôfago são, na imensa maioria das vezes, um dentre dois tipos histológicos: carcinomas espinocelulares (CEC) ou adenocarcinomas, doenças distintas, que acometem populações distintas e têm comportamento biológico muito diferente.
No Brasil, há um predomínio maciço dos carcinomas espinocelulares, que correspondem a 96% dos cânceres de esôfago no país. Estimativa do INCA sugere a ocorrência de 10.790 casos novos em 2018, sendo 80% em pacientes do sexo masculino. Esse perfil epidemiológico está associado ao uso do tabaco e do álcool, que também configuram risco para lesões das vias aéreas. A oncogênese de campo nos obriga a rastrear todos os pacientes com carcinoma espinocelular de cabeça e pescoço e pulmão.
Pacientes com esôfago de Barrett, principalmente se longos, ou que já tiveram em algum momento displasia identificada por biópsia, necessitam de vigilância. Em sua maioria são pacientes acima do peso, com histórico de doença do refluxo gastroesofágico crônica e os tumores se localizam no terço distal, junto à transição esôfago-gástrica (TEG).
A terapia endoscópica do câncer precoce do esôfago consiste na ressecção das camadas superficiais internas do órgão, quando a doença está a elas restrita. Vale ressaltar que a ressecção endoscópica não é apenas terapia definitiva, suas indicações como etapa diagnóstica ou de estadiamento persistem, sem qualquer prejuízo para a cirurgia, que deverá ser indicada quando os critérios de cura não forem alcançados após a abordagem endoscópica inicial das lesões superficiais.
Palavras-chave: câncer de esôfago, dissecção endoscópica, magnificação, ablação, esôfago de Barrett
Introdução
A incidência das lesões superficiais do esôfago tem aumentado e isso se deve a três fatores: rastreamento dos pacientes com maior risco de desenvolver carcinoma espinocelular, vigilância dos pacientes portadores do esôfago de Barrett e maior disponibilidade de exames endoscópicos de qualidade1.
Métodos de cromoscopia óptica, acessíveis com o apertar de um botão nos aparelhos endoscópios mais modernos, e de cromoscopia clássica, com utilização de lugol a 1,5%, se equivalem, sendo ambos capazes de aumentar a sensibilidade da endoscopia para detecção das lesões superficiais. A utilização de aparelhos de alta definição e o treinamento dos examinadores tem impacto superior ao das cromoscopias nas taxas de detecção de doença neoplásica superficial.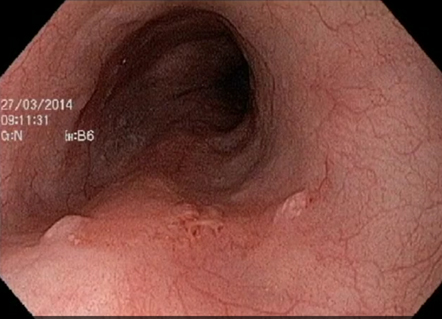
Figura 1- neoplasia superficial à luz branca
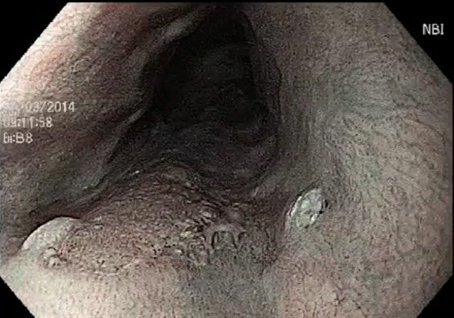 Figura 2- Mesma lesão à cromoscopia óptica com NBI
Figura 2- Mesma lesão à cromoscopia óptica com NBI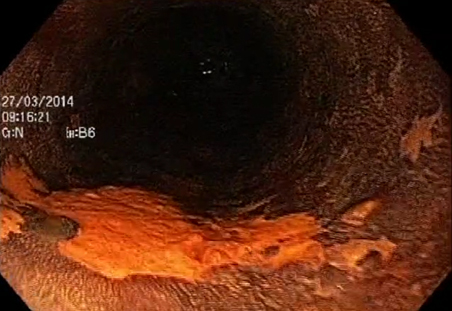
Discussão - Quando?
Classicamente, as neoplasias superficiais do esôfago eram divididas em T1a, restritas à camada mucosa, e T1b, casos nos quais os tumores alcançam a submucosa. Porém, após o desenvolvimento de técnicas endoscópicas mais minuciosas, como a ESD, do inglês, Endoscopic Submucosal Dissection, a escola japonesa passou a "enxergar" mais camadas na parede esofágica e correlacioná-las ao impacto prognóstico, definindo quais são os melhores candidatos para tratamento por técnicas menos invasivas.
T1 – mucosa e submucosa | T1a – mucosa | T1m1 – intraepitelial (T1a – EP) |
T1m2 – lâmina própria (T1a – LPM) | ||
T1m3 – muscular da mucosa (T1a- MM) | ||
T1b – submucosa | T1sm1 – submucosa superficial | |
T1sm2 – profundidade > 200 µm | ||
T1sm3 | ||
T2 – muscular própria | T2 – muscular própria | T2 – muscular própria |
(Tabela 1: tabela de estratificação de camadas da parede esofágica)
Os tumores T1m1 e T1m2 têm indicação precisa para tratamento endoscópico. Já os tumores T1m3 e T1sm1 têm indicação relativa, devendo a análise histológica detalhada do espécime removido definir quais casos merecem abordagem cirúrgica complementar3.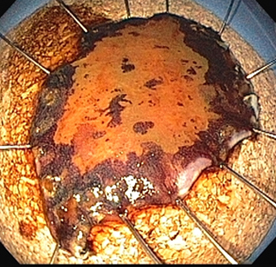
Figura 4 - peça de ressecção com técnica de ESD
Trabalho japonês que analisou os CEC - T1m3 ressecados pela técnica de ESD evidenciou a importância da avaliação da invasão angiolinfática nas peças dissecadas. Entre os pacientes que tiveram invasão angiolinfática identificada no anatomopatológico, 47% evoluíram com metástases no intervalo de cinco anos que se seguiram à ressecção. Já entre os que não tiveram essa invasão vascular observada, a ocorrência de metástases nesse mesmo período foi de apenas 0,7%6.
Portanto, é muito importante definir a profundidade da lesão na parede esofágica. O exame endoscópico minucioso com aparelho de luz branca em alta definição sugere lesão superficial quando a distensibilidade do órgão está preservada, não há úlcera e nem estenose da luz. Diante dessa possibilidade, o ultrassom endoscópico (USE), com uso de probe radial, é o exame de eleição, capaz de determinar a profundidade da lesão na parede do órgão ao mesmo tempo em que permite vasculhar as adjacências à procura de linfonodos suspeitos2. Quanto maior a frequência dos ultrassons utilizados, maior o número de camadas observadas na parede do órgão e maior a acurácia do estadiamento T. Já para a avaliação dos linfonodos (N), sabe-se que a punção com agulha de todo gânglio suspeito com tamanho superior a 10mm também colabora para o aumento na acurácia, principalmente se houver patologista disponível para acompanhar as punções na sala de exames.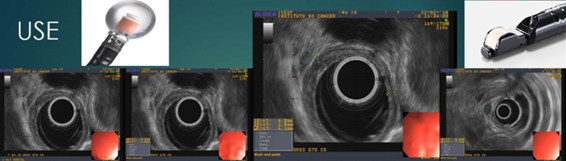
Figura 5 - ultrassom endoscópico identificando espessamento da parede esofágica e linfonodo perilesional.
Recentemente, à semelhança do que já ocorre nas lesões colônicas, nas quais a identificação dos padrões de cripta de Kudo aumentou a acurácia na determinação da profundidade das lesões na parede intestinal, a magnificação dos carcinomas espinocelulares superficiais do esôfago com observação do IPCL (do inglês, intra papillary capillary loop) à cromoscopia óptica com sistema NBI-ME (do inglês, narrow band imaging – magnifying endoscopy) permite identificar os padrões da microvascularização segundo a classificação da JES (Japanese Esophageal Society), cuja acurácia na definição da profundidade da lesão já foi determinada e atualmente tem sido revalidada em centros de todo o mundo7.
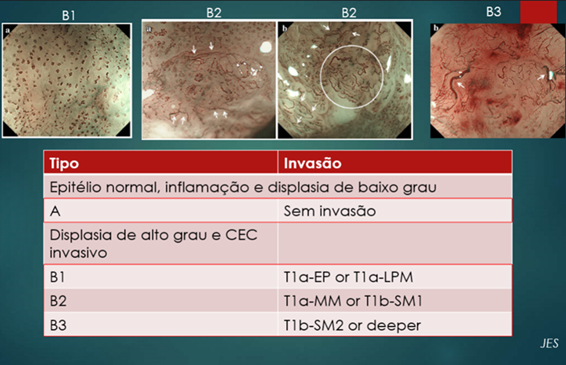 Figura 6 - Padrões vasculares dos IPCL ao NBI-ME e sua correlação histológica.
Figura 6 - Padrões vasculares dos IPCL ao NBI-ME e sua correlação histológica.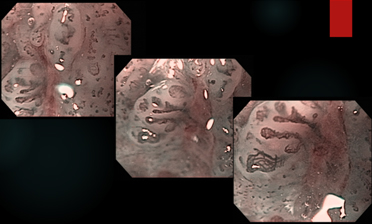
Figura 7- NBI-ME de lesão esofágica identificando IPCL de padrão B2 (T1m3 ou T1sm1).
Assim, respondemos a primeira questão: quando? Sempre que se estiver diante de um paciente com lesão esofágica superficial, quer seja um CEC com NBI-ME padrão B1 ou B2 ou uma área de esôfago de Barrett com displasia ou adenocarcinoma superficial.
Discussão – Como?
Quanto a forma de se proceder a terapia endoscópica, as técnicas de ressecção são as melhores alternativas: EMR: Endoscopic Mucosal Ressection; EPMR: Endoscopic Piece Meal Ressection; e ESD: Endoscopic Submucosal Dissection. Essa última é a mais capaz de garantir a ressecção em monobloco, permitindo melhor qualidade de análise histológica após ressecção4,5. Porém, tecnicamente é mais desafiadora, principalmente no terço distal do esôfago, junto da área dos batimentos cardíacos e movimentos ventilatórios do diafragma.
Pelas altas taxas de recorrência, principalmente metacrônicas, observadas após ressecções dos CECs superficiais, procuramos abordar essas lesões sempre com a técnica mais eficaz, a ESD. Quando tratamos adenocarcinomas ou áreas de displasia no Barrett os resultados do tratamento endoscópico são mais satisfatórios, mesmo com a aplicação de técnicas não tão elaboradas. O uso da EMR abordando o foco de maior displasia dentro da mucosa metaplásica do esôfago de Barrett é bem aceito, pois produz bons resultados desde que se prossiga com o tratamento de todo o restante do epitélio metaplásico9.
Quando o desafio de lesões longas, circunferenciais, em posição de difícil acesso, superar nossa capacidade de ressecção endoscópica, dispomos de métodos alternativos: ablação por radiofrequência, crioablação e terapia fotodinâmica.
A radiofrequência merece destaque especial. Apesar da grande experiência internacional, ela é recém-chegada ao nosso país. Possui opções para ablação circunferencial com balão ou focal, ambas guiadas pela endoscopia digestiva, e tem todo potencial para repetir os resultados observados em estudos estrangeiros, nos quais se mostrou um ótimo método adjuvante à terapia de ressecção endoscópica, nunca como primeira opção terapêutica.
Trabalho chinês bastante didático publicado em fevereiro de 2018 na revista Endoscopy acompanhou 35 pacientes com carcinomas espinocelulares superficiais de esôfago, todos tratados com a proposta de abordagem inicial por radiofrequência10. Com a primeira ablação com balão, 25 deles tiveram remissão completa no seguimento de 1 ano. Os outros 10 tiveram lesão residual identificada, que foram tratadas com nova sessão de radiofrequência utilizando-se o probe focal; nesse segundo grupo, 2 pacientes tiveram doença persistente. Do total, 31 pacientes conseguiram remissão completa em 1 ano, e dentre estes 6 evoluíram com recidiva. Tanto esses 6 casos de recidiva, quanto os 2 da doença persistente foram tratados com ESD e persistiram livres de doença no seguimento. Na análise das peças ressecadas destes 8 pacientes submetidos a terapia de resgate com ESD se observou que dois pacientes tinham doença mais profunda que a identificada no estadiamento inicial (tumores T1b – SM1), enquanto os outros seis eram doença superficial (T1a), mas que envolvia os ductos glandulares, a partir de onde voltavam a crescer. Todos esses oito casos teriam sido resolvidos com abordagem inicial por ressecção endoscópica, que também possibilitaria o correto diagnóstico histológico.
A crioablação encontra seu espaço nas situações onde o maior desafio é a estenose da luz esofágica após a terapia endoscópica. Já a terapia fotodinâmica tem grande potencial de melhoria de desempenho, por ser dependente de três variáveis: fotossensibilizador, fonte de luz e dano tecidual pelo oxigênio. Ela tem três frentes de atuação para evolução e a endoscopia tem sido bastante estudada para contribuir em duas delas: com aplicação local do fotossensibilizador (spray, injeção, prótese auto expansível) ou como carregadora da fonte de luz para que ocorra ganho de eficácia ao se utilizar luzes de diferentes comprimentos de onda. Por diferentes motivos, sendo um deles a complexidade da aplicação, a terapia fotodinâmica ainda não se disseminou pelo mundo como técnica de tratamento das lesões precoces do esôfago.
Assim, sempre que possível a abordagem utiliza ESD e quando esta for inviável outras técnicas de ressecção (EMR ou EPMR) podem e devem ser empregadas, complementadas por técnicas de ablação, se necessário.
Discussão – Para quem?
Se antes as terapias endoscópicas eram vistas como um método alternativo para os que não tinham condições clínicas de se submeter a uma cirurgia de grande porte como é a esofagectomia, atualmente essa percepção mudou. O avanço nas técnicas diagnósticas e terapêuticas permitiu melhor seleção dos pacientes e passamos a oferecer a medicina personalizada que tanto almejamos. O tratamento adequado, nem a mais e nem a menos, para aquele paciente com o estadiamento que se faz no momento do diagnóstico. Mas, isso tem seu preço. Se passamos a preservar os órgãos, faz-se necessário maior vigilância sobre eles. Além disso, com a aplicação de técnicas menos invasivas, um escalonamento das terapias disponíveis pode ser necessário. Houve um tempo em que encontrar um foco de displasia de alto grau no esôfago de Barrett era indicativo de esofagectomia. Hoje, faz-se a ressecção endoscópica, e não sendo possível a ESD, utiliza-se a ressecção focal complementada pela ablação do epitélio metaplásico. Se o resultado histológico for satisfatório, o paciente segue em acompanhamento endoscópico. Em caso de recidiva da displasia ou do adenocarcinoma superficial pode-se discutir a reabordagem endoscópica ou a esofagectomia.
Ainda não temos a resposta final para essa pergunta, ‘para quem’? Talvez, com o rápido desenvolvimento das técnicas genéticas e moleculares, chegaremos a essa resposta. No momento, pacientes mais jovens ou com oncogênese de campo bem evidente têm recebido o tratamento mais agressivo, quer seja pela agressividade da replicação celular ou pela possibilidade de desenvolver lesões multicêntricas.
Conclusão
Em conclusão, os tumores T1m1 e T1m2 têm indicação precisa para tratamento endoscópico. Já os tumores T1m3 e T1sm1 têm indicação relativa, devendo a análise histológica detalhada do espécime removido definir quais casos merecem abordagem cirúrgica complementar. Sempre que possível a abordagem deve ser feita com ESD e quando esta for inviável passamos a outras técnicas de ressecção (EMR ou EPMR) que podem e devem, sempre que se julgar necessário, ser complementadas por técnicas de ablação. As evidências disponíveis não permitem refinar a seleção de pacientes e atualmente os mais jovens ou com oncogênese de campo bem evidente têm recebido o tratamento mais agressivo.
Referências:
Lambert R, et al. Superficial neoplastic lesions in the digestive tract. Endoscopy 2005;37: 570-8
Pouw RE, Heldoorn N, Alvarez Herrero L, et al. Do we still need EUS in the workup of patients with early esophageal neoplasia? A retrospective analysis of 131 cases. Gastrointest Endosc 2011; 73:662.
Treatment trends, risk of lymph node metastasis, and outcomes for localized esophageal cancer. J Natl Cancer Inst 2014;106
Takahashi H, Arimura Y, Masao H, et al. Endoscopic submucosal dissection is superior to conventional endoscopic resection as a curative treatment for early squamous cell carcinoma of the esophagus. Gastrointestinal Endosc 2010; 72:255
Cao Y, Liao C, Tan A, et al. Meta-analysis of endoscopic submucosal dissection versus endoscopic mucosal resection for tumors of the gastrointestinal tract. Endoscopy 2009; 41:751
Yamashina T, Ishihara R, Nagai K, et al. Long-term outcome and metastatic risk after endoscopic resection of superficial esophageal squamous cell carcinoma. Am J Gastroenterol 2013; 108:544
Oyama T, Inoue H, Arima M, et al. Prediction of the invasion depth of superficial squamous cell carcinoma based on microvessel morphology: magnifying endoscopic classification of the Japan Esophageal Society. Esophagus, 2017
Westerterp M, Koppert LB, Buskens CJ, et al. Outcome of surgical treatment for early adenocarcinoma of the esophagus or gastro-esophageal junction. Virchows Arch 2005;446:97
Pech O, Behrens A, May A, et al. Long-term results and risk fator analysis for recurrence after curative endoscopic therapy in 349 patients with high-grade intraepithelial neoplasia and mucosal adenocarcinoma in Barrett’s oesophagus. Gut 2008; 57:1200;105-112
Wen-Lun W, I-Wei C, Chien-Chuan C, Chi-Yang C, Cheng-Hao T, Chi-Ming T. Lessons from pathological analysis of recurrent early squamous cell neoplasia after complete endoscopic radiofrequency ablation. Endoscopy 2018. DOI: 10.1055/s-0044-101352
[sexypolling id="6"]




