 A médica Gilmara Resende (foto), oncologista na Fundação Centro de Controle de Oncologia do Amazonas (FCECON) e Sensumed Oncologia Clínica em Manaus-AM, discute em artigo os estudos que avaliam o uso de antiangiogênicos no câncer epitelial de ovário.
A médica Gilmara Resende (foto), oncologista na Fundação Centro de Controle de Oncologia do Amazonas (FCECON) e Sensumed Oncologia Clínica em Manaus-AM, discute em artigo os estudos que avaliam o uso de antiangiogênicos no câncer epitelial de ovário.
{jathumbnail off}Os carcinomas de ovário representam a 5ª causa de morte em mulheres na Europa e aproximadamente 65.600 casos foram diagnosticados em 2012. A maioria das pacientes, no momento do diagnóstico, já se apresentam com doença em estádios avançados (III ou IV).
Mesmo com o tratamento inicial agressivo e multidisciplinar (citorredução cirúrgica + quimioterapia à base de platina e taxano), a maioria das pacientes com estádios avançados irão recair e se tornarão resistentes às modalidades terapêuticas atuais.
A angiogênese é um processo dinâmico, complexo e altamente regulado, possibilitando à célula neoplásica proliferação, diferenciação, vascularização e crescimento tumoral. A perfeita harmonia entre fatores pró e anti-angiogênicos no micro-ambiente tumoral faz parte do processo crucial de angiogênese.
VEGF, FGF, PDGF são citocinas celulares atuantes como pró-angiogênicos e alvo para as novas terapias, seja inibindo seu receptor ou sua ação. Endostatina, angiostatina e trombospodina funcionam como anti-angiogênicos.
Os primeiros estudos clínicos utilizaram bevacizumabe (Avastin), anticorpo monoclonal IgG que se liga ao VEGF A, como potente inibidor da angiogênese. Em combinação com quimioterapia, ele se mostrou uma droga eficaz e com bom perfil de tolerabilidade em vários estudos clínicos.
O estudo GOG 218 foi um estudo controlado por placebo com três braços. 1873 mulheres com doença avançada; 40% das pacientes tinham doença em estádio III com doença residual superior a 1 cm e 26% tinham doença em estádio IV. No tratamento padrão, as pacientes receberam carboplatina (AUC 5 ou 6) e paclitaxel 175 mg/m2 a cada 3 semanas por seis ciclos. Bevacizumabe em outros 2 braços associado à quimioterapia por 2-6 ciclos e, em seguida, manutenção com placebo ou bevacizumabe a cada três semanas até um total de 22 ciclos.
As pacientes que foram tratadas com bevacizumabe concomitante e manutenção obtiveram sobrevida livre de progressão significativamente prolongada quando comparada com a quimioterapia isoladamente (14,1 versus 10,3 meses; hazard ratio [HR], 0,717; 95% CI, 0,625-0,824; P = 0,001). Não houve diferença em sobrevida global.
A dose de bevacizumabe foi 15 mg/kg por via intravenosa, o que foi o dobro da dose utilizada no estudo ICON 7.
O estudo ICON 7 randomizou pacientes para 2 braços de estudo, carboplatina mais paclitaxel por 6 ciclos a cada 3 semanas, comparando o mesmo regime de quimioterapia, adicionando-se bevacizumabe na dose de 7,5mg/Kg por 12 ciclos ou até progressão de doença.
O braço bevacizumabe mostrou ganho mediano de sobrevida livre de progressão de dois meses. Uma análise exploratória de 502 pacientes que tiveram a doença com mau prognóstico (histologia células claras e grau III) mostrou diferença significativa na sobrevida global em mulheres que receberam a associação de medicações em comparação com aquelas que receberam quimioterapia isolada (tempo médio de sobrevida de 34,5 meses [95% CI: 32,0-37,0] com a quimioterapia padrão versus 39,3 meses [37,0-41,7] com bevacizumabe; log-rank p = 0,03).
Para pacientes não consideradas de alto risco, a mediana de sobrevida não mostrou diferença significativa entre os dois grupos de tratamento (49,7 meses [95% CI: 48.3-51.1]) no grupo de quimioterapia padrão em comparação com 48,4 meses [47,0-49,9] no grupo bevacizumabe; p = 0,20).
O estudo OCEANS multicêntrico, cego, randomizado, controlado por placebo de fase III, recrutou 484 pacientes com câncer de ovário recidivado sensível à platina.
Os braços do estudo utilizaram carboplatina mais gemcitabina combinado com bevacizumabe ou placebo por 6 a 10 ciclos. Bevacizumabe ou placebo foi continuada até progressão de doença. Sobrevida livre de progressão para o braço bevacizumabe foi superior ao placebo – 12,4 x 8,4 meses (HR – 0.484; 95%CI, 0.388 to 0.605; log-rank P <.0001). Além disso, houve uma melhora significativa na taxa de resposta objetiva (78,5% versus 57,4%; p <0,0001), e duração da resposta (10,4 X 7,4 meses; HR, 0,534; 95%: CI: 0,408-0,698) com a adição de bevacizumabe. Não houve benefício de sobrevida global para pacientes que receberam bevacizumabe em comparação com o grupo placebo (33,6 meses versus 32,9 meses, respectivamente).
O estudo AURELIA foi o primeiro fase III randomizado, aberto, avaliando bevacizumabe em combinação com quimioterapia em pacientes resistentes à platina. O estudo envolveu 361 pacientes com câncer de ovário que progrediram em menos de 6 meses após a conclusão do tratamento baseado em platina. As drogas utilizadas isoladas ou em combinação foram doxorrubicina lipossomal, paclitaxel semanal e topotecano conforme escolha do investigador. Bevacizumabe (10 mg/kg a cada duas semanas ou 15 mg/kg de três em três semanas) foi administrado até progressão, toxicidade inaceitável ou retirada do protocolo. A sobrevida livre de progressão foi 3,4 meses X 6,7 meses em favor da combinação.
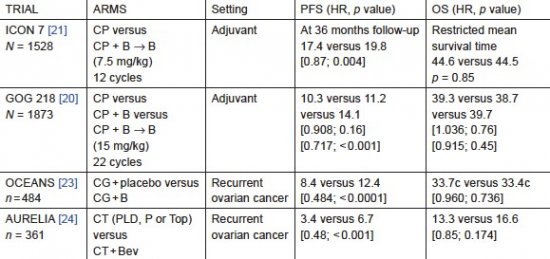
Tabela 1. Estudos clínicos de fase III com Bevacizumabe
Os estudos positivos de Fase III com o uso de bevacizumabe em câncer de ovário utilizaram como endpoint primário a sobrevida livre de progressão. Ainda não está claro se a melhora na sobrevida livre de progressão se traduzirá em melhora na qualidade de vida e em ganho de sobrevida global.
Na maior parte dos estudos, foi permitido cross-over que variou de 31 a 40%, podendo confundir a análise de sobrevida global.
No estudo ICON-7, uma análise exploratória dos pacientes considerados de alto risco mostrou vantagem em termos de sobrevida global com bevacizumabe.
Inibidores de tirosina quinase
Cediranibe é um inibidor de VEGFR 1-3 e c-Kit. O estudo de fase III, ICON6, incluiu 456 pacientes com câncer de ovário recorrente sensível à platina e adicionou cediranibe à quimioterapia à base de platina seguido de cediranibe de manutenção. Foram três braços no estudo: quimioterapia à base de platina com manutenção com placebo; quimioterapia concomitante com cediranibe (20 mg/dia), seguido de placebo manutenção; e quimioterapia concomitante com cediranibe seguido de manutenção com cediranibe por 18 meses.
O braço manutenção com cediranibe mostrou melhora na mediana de sobrevida livre de progressão e sobrevida global (11 x 8,7 meses, HR 0,56; p<0.0001) e (26,3 x 21 meses, HR 0.77; p = 0,11), respectivamente. Ainda sao necessários dados maduros em sobrevida global. A toxicidade com a combinação foi considerada manejável.
Outros inibidores de tirosina quinase
Pazopanibe
O estudo AGO-OVAR 16 avaliou pazopanibe em manutenção após quimioterapia padrão com paclitaxel e carboplatina em 940 pacientes com estágio II a IV EOC. O endpoint primário foi a sobrevida livre de progressão
Os pacientes designados para receber pazopanibe manutenção apresentaram ganho de 5,6 meses em sobrevida livre de progressão em comparação com o grupo placebo (HR, 0,77; IC 95%, 0,64-0,91; P 0,0021), sem ganho de sobrevida global. Outros inibidores de tirosina quinase como sunitinibe e sorafenibe estão em estudo.
Os tumores de ovário constituem um grupo extremamente heterogêneo e biologicamente distinto tanto na apresentação inicial, como na recidiva. Outros subgrupos histológicos como carcinoma de células claras, baixo grau seroso e alto grau seroso se mostram de comportamento biologicamente distintos.
A maioria dos estudos mostra benefício modesto em termos de sobrevida livre de progressão, sem impacto em sobrevida global. Ainda não se sabe a melhor estratégia terapêutica, tempo de duração do tratamento e dose ideal. Além disso, busca-se biomarcadores capazes de se traduzir em resposta terapêuticaem grupos mais susceptíveis que possam se beneficiar de anti-angiogênicos. Na decisão terapêutica, deve-se levar em consideração os custos da incorporação desses novos agentes ao tratamento, já que nenhum se mostrou custo-efetivo.
Palavras –chave: câncer de ovário, antiangiogênese, bevacizumabe, inibidores de tirosina quinase
Autora: Gilmara A. S. Resende, Oncologista Clínica, Residência Médica no Hospital de Câncer de Barretos, Associada do Grupo Brasileiro de Tumores Ginecológicos (GBTG/EVA), Oncologista Clínica na Fundação Centro de Controle de Oncologia do Amazonas (FCECON) e Sensumed Oncologia Clínica em Manaus-AM.
Referências Bibliográficas
1. Burger RA, Brady MF, Bookman MA, et al: Incorporation of bevacizumab in the primary treatment of ovarian cancer. N Engl J Med 365:2473-2483, 2011 11.
2. Perren TJ, Swart AM, Pfisterer J, et al: A phase 3 trial of bevacizumab in ovarian cancer. N Engl J Med 365:2484-2496, 2011 12.
3. Oza AM, Cook AD and Pfisterer J et al (2015) Standard chemotherapy with or without bevacizumab for women with newly diagnosed ovarian cancer (ICON7): overall survival results of a phase 3 randomised trial Lancet Oncol.
4. Aghajanian C, Blank SV, Goff BA, et al: OCEANS: A randomized, doubleblind, placebo-controlled phase III trial of chemotherapy with or without bevacizumab in patients with platinum-sensitive recurrent epithelial ovarian, primary peritoneal, or fallopian tube cancer. J Clin Oncol 30:2039-2045, 2012 14.
5. Pujade-Lauraine E, Hilpert F, Weber B, et al: Bevacizumab combined with chemotherapy for platinum-resistant recurrent ovarian cancer: The AURELIA open-label randomized phase III trial. J Clin Oncol 32:1302-1308, 2014 15.
6. Pujade-Lauraine E, Hilpert F and Weber B et al (2014) Bevacizumab combined with chemotherapy for platinum-resistant recurrent ovarian cancer: the AURELIA open-label randomized phase III trial J Clin OncolJCO.2013.51.4489
7. Du Bois A, Floquet A, Kim J-W, et al: Incorporation of pazopanib in maintenance therapy of ovarian cancer. J Clin Oncol 32:3374-3382, 2014.
8. Ledermann, Jonathan A et al. Cediranib in patients with relapsed platinum-sensitive ovarian cancer (ICON6): a randomised, double-blind, placebo-controlled phase 3 trial. The Lancet , Volume 387 , Issue 10023 , 1066 – 1074.




