A Agência Nacional de Vigilância Sanitária (ANVISA) aprovou nova indicação de cemiplimabe (Libtayo®, Sanofi), agora como monoterapia para câncer de pulmão de não pequenas células avançado, em pacientes com alta expressão de PD-L1 (≥50% das células tumorais)1. A decisão da Anvisa foi anunciada no dia 23 de maio e é baseada nos resultados de estudo internacional de Fase 3 (EMPOWER LUNG 1)2, que demonstrou benefício significativo de sobrevida global e sobrevida livre de progressão da monoterapia com cemiplimabe nessa população de pacientes.
Este estudo aberto, de Fase 3, inscreveu pacientes com câncer de pulmão de não pequenas células (CPNPC) recrutados em 138 centros, de 24 países. Foram elegíveis pacientes adultos (≥18 anos) com doença avançada, histologicamente ou citologicamente confirmada e bom status de desempenho (ECOG de 0-1), randomizados (1:1) para cemiplimabe 350 mg a cada 3 semanas por administração intravenosa ou quimioterapia com doublet de platina.
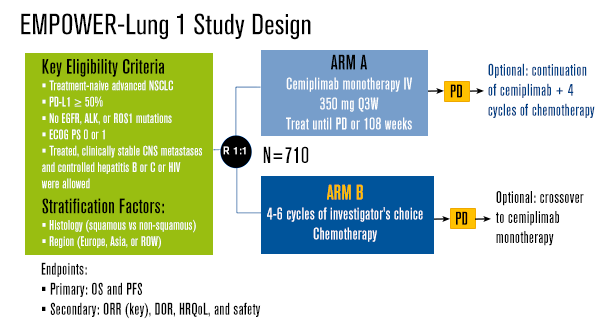
A randomização foi estratificada por histologia do tumor (escamoso vs não escamoso) e região geográfica (Europa, Ásia ou resto do mundo). O estudo incluiu pacientes com metástases cerebrais clinicamente estáveis, população geralmente subrepresentada em ensaios clínicos. O protocolo da pesquisa permitiu o cruzamento da quimioterapia para o braço cemiplimabe após a progressão da doença. Os endpoints primários foram sobrevida global e sobrevida livre de progressão (RECIST v 1.1) avaliados por comitê de revisão independente e cego na população com intenção de tratar (ITT) e em pacientes com alta expressão de PD-L1 (≥50% das células tumorais).
Na análise de segurança, os eventos adversos foram avaliados em todos os pacientes que receberam pelo menos uma dose do tratamento experimental. Resultados detalhados foram reportados por Sezer et al. no Lancet Oncology (2021).
O estudo incluiu 710 pacientes com CPNPC, estágio IIIB a IV (população ITT), entre 27 de junho de 2017 e 27 de fevereiro de 2020). Os resultados demonstraram que cemiplimabe cumpriu os principais endpoints de eficácia e segurança, com sobrevida global superior e benefício significativo de sobrevida livre de progressão.
No grupo com expressão de PD-L1 ≥ 50% (N= 563), a sobrevida global mediana não foi alcançada (IC 95% 17·9-não avaliável) com cemiplimabe (N=283) versus 14,2 meses (IC 95% 11,2 - 17,5) com quimioterapia (N=280; razão de risco [HR] 0,57 [0,42-0,77]; p=0,0002), indicando que nessa população, cemiplimabe reduziu em 43% o risco de morte. As taxas estimadas de SG em 24 meses foram de 50% vs 27% (veja abaixo).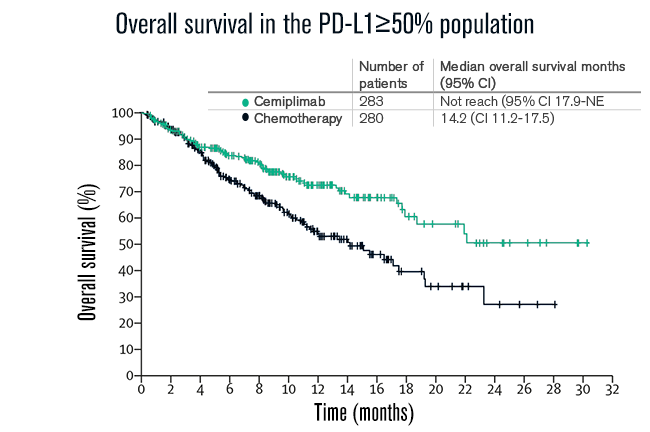
Na análise de subgrupos, cemiplimabe mostrou redução de 83% no risco de morte na população com metástase cerebral e diminuiu em 52% o risco de morte em pacientes com carcinoma de células escamosas. A sobrevida livre de progressão mediana em pacientes com alta expressão de PD-L1 também foi superior com cemiplimabe versus quimioterapia (8,2 meses (IC 95% 6,1-8,8) versus 5,7 meses (IC 95% 4,5-6,2); (HR 0,54 [0,43-0,68]; p<0·0001). Entre os pacientes com alta expressão de PD-L1, cemiplimabe levou a uma ORR de 39,2% (IC 95%, 33,5% - 45,2%) versus 20,4% (IC 95%, 15,8% - 25,6%) com quimioterapia (P < 0,0001).
Os regimes de quimioterapia mais empregados foram paclitaxel mais carboplatina (n = 127), pemetrexede mais carboplatina (n = 98) e gencitabina mais carboplatina (n = 40).
Benefícios significativos na sobrevida global e na sobrevida livre de progressão também foram observados com cemiplimabe na população com intenção de tratar, apesar da alta taxa de cross over do braço controle para o braço experimental (74%). Na população ITT, o acompanhamento mediano foi de 13,1 meses (intervalo interquartil [IQR] = 8,6–20,2 meses) no grupo de cemiplimabe e de 13,1 meses (IQR = 8,7–20,1 meses) no grupo de quimioterapia. A sobrevida global mediana foi de 22,1 meses (IC 95%, 17,7 - não avaliável) no grupo de cemiplimabe versus 14,3 meses (IC 95%, 11,7–19,2) no grupo de quimioterapia (razão de risco [HR] = 0,68, 95% IC = 0,53–0,87, P = 0,0022). A mediana de sobrevida livre de progressão na população ITT foi de 6,2 meses (IC 95%, 4,5 – 8,3) vs 5,6 meses (IC 95%, 4,5–6,1; HR = 0,59, IC 95% = 0,49–0,72, P < 0,0001).
Na população ITT, a ORR alcançada também foi superior entre os pacientes tratados com cemiplimabe, com 36,5% (IC 95%, 31,5%-41,8%) em comparação com apenas 20,6% (IC 95%, 16,5%-25,2%) com quimioterapia (P < 0,0001).
Eventos adversos de grau 3-4 relacionados ao tratamento ocorreram em 41 (12%) de 355 pacientes tratados com cemiplimabe e em 127 (37%) de 342 pacientes que receberam quimioterapia. Assim, a análise de segurança mostrou maior risco de desenvolver EAs de grau 3 ou 4 com quimioterapia em comparação com cemiplimabe.
Em conclusão, a monoterapia com cemiplimabe melhorou significativamente a sobrevida global e a sobrevida livre de progressão comparada à quimioterapia em pacientes com câncer de pulmão de não pequenas células avançado com PD-L1 de pelo menos 50%, fornecendo nova opção de tratamento para essa população de pacientes.
População ITT Pacientes no início do estudo |
Cemiplimabe tem indicação para o tratamento do carcinoma espinocelular (CEC) localmente avançado ou metastático e para o tratamento do carcinoma basocelular localmente avançado ou metastático, em pacientes previamente tratados com inibidor da via Hedgehog(IHH) ou aqueles inelegíveis para o tratamento com IHH. Esta é a terceira indicação do anti PD-1 cemiplimabe no Brasil, a primeira com impacto na oncologia torácica.
"Com esta terceira aprovação para Libtayo®, estamos orgulhosos de cumprir nossa ambição de levar nosso inibidor de PD-1 a pacientes com cânceres difíceis de tratar, como o câncer de pulmão de não pequenas células avançado", disse Peter C. Adamson, chefe de Desenvolvimento Global de Oncologia e Inovação da Sanofi. "Como a principal causa de mortes por câncer em todo o mundo, o CPNPC avançado tem claramente a necessidade de opções terapêuticas adicionais. A aprovação de Libtayo permite que os médicos otimizem ainda mais o tratamento desses pacientes cujos tumores têm alta expressão de PD-L1”, destacou.
Este estudo está registrado na ClinicalTrials.gov: NCT03088540.
Referências:
Diário Oficial da União - Resolução-RE nº 1.650, de 19 de maio de 2022 - Publicado em: 23/05/2022 | Edição: 96 | Seção: 1 | Página: 258
- Sezer A, Kilickap S, Gumus M, Bondarenko I, Ozguroglu M, Gogishvili M, et al. Cemiplimab monotherapy for first-line treatment of advanced non-small-cell lung cancer with PD-L1 of at least 50%: a multicentre, open-label, global, phase 3, randomised, controlled trial. Lancet. 2021;397(10274):592-604





