 Em artigo, o oncologista Duílio Reis da Rocha Filho (foto) comenta as novas perspectivas em tumores neuroendócrinos (TNEs) do trato digestivo, e levanta questões como a avaliação de resposta ao tratamento e a melhor sequência entre as diferentes modalidades de terapia, que ainda permanecem sem resposta clara.
Em artigo, o oncologista Duílio Reis da Rocha Filho (foto) comenta as novas perspectivas em tumores neuroendócrinos (TNEs) do trato digestivo, e levanta questões como a avaliação de resposta ao tratamento e a melhor sequência entre as diferentes modalidades de terapia, que ainda permanecem sem resposta clara.
{jathumbnail off}*Duílio Reis da Rocha Filho
Os tumores neuroendócrinos (TNEs) são uma condição de incidência crescente. Dentre os TNEs, os tumores do trato digestivo são os mais comuns. Costumam ser neoplasias indolentes, embora o comportamento clínico seja heterogêneo e dependa de parâmetros como grau de diferenciação e sítio primário. Podem estar associados a sintomas secundários à produção hormonal, como na síndrome carcinoide. Uma cuidadosa avaliação com exames complementares é essencial no manejo de pacientes com TNE. Biomarcadores como a cromogranina e o ácido 5-hidroxiindolacético (5-HIAA) têm ampla aplicabilidade, mas a sensibilidade ou especificidade dos marcadores disponíveis é deficiente. Tomografias e ressonâncias são exames de imagem fundamentais no diagnóstico e no acompanhamento da doença, embora a avaliação de resposta de acordo com Response Evaluation Criteria in Solid Tumors (RECIST) tenha limitações em TNE. Exames funcionais, como cintilografias de receptores de somatostatina e FDG-PET-CT, têm papel definido em diferentes cenários clínicos e são úteis para a programação terapêutica. Múltiplas modalidades de tratamento, incluindo análogos de somatostatina, terapias-alvo, quimioterapia (QT), radioisótopos e terapias locais, têm papel assegurado no manejo da doença. Desde 2009, dez estudos de fase III trouxeram novas perspectivas para os pacientes com TNE, mas questões como a melhor forma de avaliar resposta ao tratamento e de sequenciar as diferentes modalidades de terapia permanecem sem resposta clara.
PALAVRAS-CHAVE
Tumores neuroendócrinos; cintilografia de receptores de somatostatina; 68Ga-PET-CT; análogo da somatostatina; everolimo; sunitinibe; lutécio radioativo.
INTRODUÇÃO
Chamamos de TNEs os tumores epiteliais com diferenciação predominantemente neuroendócrina, que podem surgir na maior parte dos órgãos do corpo (KLIMSTRA, 2010). Quase dois terços dos tumores têm origem gastroenteropancreática (MODLIN, 2003). Entre 1973 e 2004, a incidência nos EUA saltou de 1,09 para 5,25 novos casos por 100.000 habitantes (YAO, 2008).
Os TNEs gastroenteropancreáticos (TNE-GEP) costumam ser pouco sintomáticos até fases avançadas da doença. Podem ser acompanhados de sintomas secundários à produção hormonal, como na síndrome carcinoide, caracterizada por crises de rubor facial, diarreia e, menos frequentemente, broncoespasmo, além de lesões valvares em câmaras cardíacas direitas. A síndrome carcinoide é identificada com maior frequência no TNE de origem em território jejunoileal, quase exclusivamente na presença de metástases hepáticas. Cerca de 30% dos TNEs pancreáticos (TNE-P) acompanham-se de sintomas hormonais, mais comumente decorrentes da produção de insulina ou de gastrina (tabela 1).
| Nome | Peptídeo | Localização | Malignidade (%) | Apresentação |
| Insulinoma | Insulina | Pâncreas (>99%) | <10 | Hipoglicemia |
| Gastrinoma | Gastrina | Duoodeno (70%), pâncreas (25%) | 60-90 | Dor, diarreia, dispepsia |
| VIPoma | VIP | Pâncreas (90%) | 40-70 | Diarreia, hipocalemia |
| Glucagonoma | Glucagon | Pâncreas (100%) | 50-80 | Rash, intolerância a glicose, perda de peso |
| Somatostatinoma | Somatostatina | Pâncreas (55%), delgado (44%) | >70 | DM, colelitíase, diarreia |
Tabela 1. Principais síndromes relacionadas a tumores neuroendócrinos pancreáticos. DM, diabetes mellitus. Adaptado de Jensen et al, 2012.
Os TNE-GEPs costumam ser indolentes, embora o comportamento clínico seja heterogêneo e dependa de parâmetros como grau de diferenciação e sítio primário. A doença pouco diferenciada tem alto potencial metastático, sobrevida mediana curta e alta quimiossensibilidade. Os tumores bem diferenciados, por outro lado, têm comportamento indolente, sobrevida mediana longa e costumam ser resistentes à quimioterapia. O sítio primário do TNE-GEP também tem importância prognóstica. Tumores de primário em delgado são mais indolentes, enquanto TNEs de pâncreas e colorretais têm pior sobrevida (YAO, 2008).
DESENVOLVIMENTO
Diagnóstico e Classificação
A taxa de proliferação celular, avaliada pelo índice Ki-67 ou pela contagem mitótica, exerce papel determinante na graduação deTNE (tabela 2) (KLIMSTRA, 2010).Há controvérsias quanto ao ponto de corte ideal de Ki-67 para a categorização dos tumores. Uma análise de 252 pacientes escandinavos com TNEs pouco diferenciados mostrou que tumores com Ki-67 superiores a 55% apresentam maior quimiossensibilidade e pior prognóstico, o que sugere que um ponto de corte mais alto de Ki-67 pode ser mais apropriado para definir os tumores de mais alto grau (SORBYE, 2013). Por outro lado, em estudo com 274 pacientes com TNE-P mostrou-se que o valor de Ki67 de 5% é um melhor discriminador prognóstico para estratificar tumores bem diferenciados, em comparação com o valor de 2% (SCARPA, 2010).
| Grau | Diferenciação | Mitoses/10 CGA | Ki67 (%) |
| 1 | Bem diferenciado | <2 | ≤2 |
| 2 | Bem diferenciado | 2-20 | 3-20 |
| 3 | Pouco diferenciado | >20 | >20 |
Tabela 2. Classificação dos tumores neuroendócrinos gastroenteropancreáticos segundo a Organização Mundial de Saúde. Adaptado de Klimstra et al, 2010.
Exames complementares
Uma cuidadosa avaliação com exames complementares é parte fundamental do manejo do TNE. Há uma necessidade não atendida de biomarcadores tumorais que preencham os parâmetros aceitáveis de eficácia (sensibilidade superior a 80%, especificidade superior a 90% e valores preditivos positivo e negativos superiores a 80%) em TNE (OBERG, 2015). Os biomarcadores atualmente disponíveis têm limitações importantes. Assim, novos métodos que reflitam de forma acurada a atividade da doença e a eficácia do tratamento são uma necessidade crucial. Técnicas como assinaturas multigênicas, monitorização de células tumorais circulantes e avaliação de miRNA são promissoras e podem preencher a carência de marcadores de alto rendimento no universo do TNE (OBERG, 2015).
A cromogranina A (CgA), um produto do grânulo secretório neuroendócrino, é o biomarcador tumoral mais útil no manejo do TNE. Está elevada em 60 a 90% dos pacientes com TNE, independente do sítio primário. Correlaciona-se com o volume tumoral e com a sobrevida e é útil para fazer seguimento clínico e para avaliar a resposta à terapia dos pacientes. Entretanto, o método de avaliação de cromogranina carece de padronização, e os resultados podem variar de acordo com os anticorpos usados na análise. Diversas condições médicas podem estar associadas a elevações de CgA, como insuficiência renal, cardiopatia, tumores não-neuroendócrinos e o uso de inibidores de bombas de prótons, o que limita a especificidade a menos de 50% (OBERG, 2015). Devido a esses aspectos, o teste é uma recomendação de categoria 3 nas diretrizes do National Comprehensive Cancer Network (NCCN), o que denota grande discordância entre os especialistas (NCCN, 2015); por outro lado, é sugerido em cada visita de seguimento pela Sociedade Europeia de Tumores Neuroendócrinos (ENETS) (PAPE, 2012). Não é um exame coberto pelas seguradoras de saúde no Brasil. Em que pesem essas limitações, recomendamos a pesquisa do marcador em intervalos de 3 a 12 meses, em conformidade com as diretrizes do ENETS, especialmente na monitorização de doentes metastáticos (PAPE, 2012). Ressalte-se que elevações de cromogranina devem ser analisadas no contexto de uma avaliação global da doença, e não devem motivar, isoladamente, alterações de conduta (NCCN, 2015). Recomenda-se que, se possível, pacientes em uso de IBP interrompam a medicação por duas semanas ou substituam-na por um antagonista do receptor H2antes de efetuar a dosagem de CgA.
O ácido 5-hidroxindolacético (5-HIAA) é um metabólito da serotonina que se correlaciona intimamente com a presença de síndrome carcinoide(VINIK, 2010). Sua elevação sugere a presença de um tumor primário de intestino médio (jejunoileal, de apêndice ou do cólon proximal), uma vez que raramente está aumentado em TNEs de outros sítios (PAPE, 2012). Sua importância é limitada pelas numerosas condições que interferem no resultado do exame.
Tabagismo, consumo de café ou álcool, alimentos como banana, abacate, abacaxi, ameixa, kiwi, espinafre e tomate e medicamentos como paracetamol, diazepam, metildopa e fenobarbital devem ser evitados nas 48 horas que antecedem a coleta (PAPE, 2012). É recomendada pelas diretrizes do NCCN e do ENETS na abordagem inicial do paciente com TNEs intestinais, especialmente se jejunoileais ou na presença de síndrome carcinoide, e nas consultas de seguimento (PAPE, 2012; NCCN, 2015).
Exames de imagem são fundamentais para localizar o tumor primário, identificar sítios de doença metastática e avaliar a resposta ao tratamento, além de investigar a expressão de receptores de somatostatina. Tomografias (TC) e ressonâncias (RNM) são os métodos anatômicos mais empregados, mas cuidados técnicos são essenciais para otimizar a sensibilidade dos exames. A RNM é ligeiramente superior à TC, principalmente na avaliação do fígado e do pâncreas. Metástases hepáticas de TNE podem ser de difícil identificação à TC, uma vez que são comumente isodensas em relação ao fígado nas imagens de fase venosa portal (figura 1). Por esse motivo, a realização de exame trifásico é recomendada (VAN ESSEN, 2014). A avaliação de resposta por RECISTtem limitações em TNE, assim como em outras neoplasias em que agentes biológicos citostáticos são parte importante do tratamento. Apesar disso, os critérios RECIST seguem sendo utilizados nos maiores estudos clínicos de TNE.
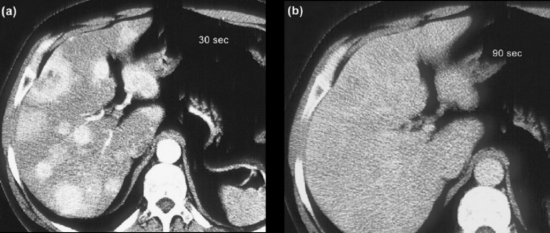
Figura 1. TC de abdome em paciente com tumor neuroendócrino com metástases hepáticas após 30 segundos (a) e 90 segundos (b) da injeção do meio de contraste. O realce das lesões desaparece na fase venosa. Adaptado de Rockall e Reznek, 2007.
Receptores de somatostatina são detectados em cerca de 90% dos pacientes com TNE, e uma cintilografia de receptores de somatostatina, como o Octreoscan e 68Ga-DOTATE-PET, deve ser considerada na avaliação inicial. Tem a vantagem de refinar o estadiamento sistêmico, ajudar na localização do tumor primário e avaliar a sensibilidade a estratégias voltadas para receptores de somatostatina (análogos e radioisótopos). O 68Ga-DOTATE-PET tem melhor resolução anatômica e acurácia, o que é importante nos casos em que a localização precisa dos sítios de doença tem potencial de mudança de conduta.
FDG-PET-CT é um exame de baixa sensibilidade na detecção de TNEs bem diferenciados (figura 2), ao passo que a taxa de detecção é alta em pacientes com Ki-67 superior a 15%. Em um estudo prospectivo, a sobrevida mediana de pacientes com FDG-PET-CT negativo e positivo foi de 119,5 meses e 15 meses, respectivamente (P<0,001) (BAHRI, 2014). Um FDG-PET-CT positivo, assim, sugere a necessidade de intervenções terapêuticas mais rigorosas.
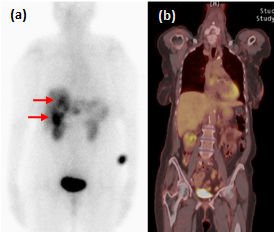
Figura 2. Exames funcionais de tumor neuroendócrino bem diferenciado metastático. Captação em fígado (setas) ao Octreoscan (a), mas não ao FDG-PET-CT (b). Adaptado de Leung et al, 2013.
Tratamento
Todos os pacientes com TNE-GEP devem ser considerados candidatos potenciais a cirurgia. No manejo da doença não passível de ressecção curativa, a definição da estratégia terapêutica depende de múltiplos parâmetros, como a diferenciação tumoral, a agressividade da neoplasia, o volume da doença e a presença de sintomas hormonais e não hormonais, e envolve intervenções locais e sistêmicas.
Doentes com TNE-GEP pouco diferenciado avançado costumam ser tratados exclusivamente com quimioterapia citotóxica. Recomendam-se regimes baseados em cisplatina, à semelhança dos utilizados no tratamento do câncer de pequenas células de pulmão. A doença é altamente sensível à QT, com taxas de resposta (TR) que chegam a 60% (VILAR, 2007). Por outro lado, a resposta ao tratamento costuma ser fugaz, e a sobrevida mediana desse grupo de doentes é de apenas 6-12 meses (YAO, 2008; SORBYE, 2013). Estudo retrospectivo mostrou que a TR à QT em doentes com TNE grau 3 e Ki-67 inferior a 55% é de apenas 15%, enquanto o grupo com maior proliferação celular tem TR de 42% (P<0,001), o que sugere que mesmo o grupo de pacientes com TNE pouco diferenciado tem comportamento heterogêneo (SORBYE, 2013).
Em doentes com TNE-GEP bem diferenciado, há múltiplas opções de tratamento. Estratégias de controle local sempre devem ser consideradasnos pacientes com doença predominantemente hepática. A sobrevida em 5 anos de pacientes submetidos a ressecção de metástases hepáticas é de 70%, enquanto não supera 50% em controles históricos (SAXENA, 2012). Ao contrário do observado em câncer colorretal, as metastasectomias raramente são curativas em TNE, de forma que, em longo prazo, a grande maioria dos doentes têm recidiva da doença. Outras estratégias locais podem ser empregadas, como ablação, embolização e, em casos muito selecionados, transplante hepático.
Os análogos de somatostatina, octreotida e lanreotida, são frequentemente a estratégia inicial de tratamento sistêmico do TNE-GEP. Em pacientes com tumores funcionantes, controlam os sintomas hormonais em até 80% dos casos, além de prover resposta bioquímica em dois terços dos doentes (PAPE, 2012). Em pacientes com TNE-GEP em progressão, o uso de análogo proporciona estabilização da doença em cerca de metade dos casos (APARICIO, 2001). Dois estudos de fase III, PROMID e CLARINET, documentaram o papel antiproliferativo dos análogos. No estudo PROMID, pacientes com tumores de intestino médio ou de sítio primário desconhecido, sem terapia prévia, foram tratados randomicamente com octreotida-LAR 30 mg a cada 28 dias ou placebo. O tempo para progressão, desfecho primário do estudo, aumentou de 5,9 meses para 15,6 meses no grupo tratado com o análogo (HR 0,33; IC 95% 0,19-0,55; P<0,001) (RINKE, 2009). O estudo CLARINET aleatorizou pacientes com TNE-GEP não-funcionantepara tratamento com lanreotida 120 mg a cada 28 dias ou placebo. Identificou-se aumento de sobrevida livre de progressão (SLP) no grupo tratado (18 meses versus não atingido; HR 0,47; IC 95% 0,30-0,73; P<0,001) (CAPLIN, 2014). Após esses estudos, o emprego de análogos passou a ser recomendado no manejo inicial de GEP-NET avançado, funcionante ou não, em especial se Ki-67 abaixo de 10%. Outra estratégia aceitável nesse grupo de doentes é um período de observação inicial, seguido por início de tratamento quando da progressão da doença. Em pacientes com tumores funcionantes, o interferon oferece controle de sintomas equiparável ao obtido com análogos, embora a toxicidade da imunoterapia tenha limitado seu emprego de forma mais ampla.
O papel das terapias-alvo no manejo do TNE pancreático bem diferenciado avançado está bem estabelecido. O estudo de fase III RADIANT-3 tratou 410 pacientes com TNE-P em progressão nos 12 meses anteriores à randomização com everolimo 10 mg/dia ou placebo.Houve um aumento da SLP mediana com o everolimo de 4,6 para 11 meses (HR 0,35; IC 95% 0,27-0,45; P<0,001) (YAO, 2011). Com desenho similar, um estudo com 171 pacientes publicado por Raymond et al mostrou que sunitinibe 37,5 mg/dia também aumenta a SLP quando comparado com placebo (mediana 5,5 versus 11,4 meses; HR 0,42; IC 95% 0,26-0,66; P<0,001). A taxa de resposta identificada foi inferior a 10%com ambas as estratégias, mas cerca de dois terços dos pacientes tratados com everolimo ou sunitinibe tiveram alguma redução da massa tumoral com o uso do biológico. Os dois estudos fizeram das terapias-alvo opção sólida no manejo inicial de TNE-P, em especial quando se documenta um maior volume de doença, ou no tratamento de segunda linha. Não há dados que comparem a eficácia de everolimo com a do sunitinibe nesse cenário, e o diferente perfil de toxicidade das drogas deve ser considerado quando da seleção do tratamento.
O impacto das terapias-alvo no tratamento do TNE gastrointestinal foi inicialmente demonstrado apenas em tumores funcionantes. O estudo RADIANT-2 comparou everolimo 10 mg/dia com placebo em pacientes com TNE não pancreático em progressão, com sintomas secretores carcinoides. Ambos os braços também receberam octreotida-LAR para controle sintomático. Observou-se um aumento não significativo da SLP mediana de 11,3 para 16,4 meses (HR 0,77; IC 95% 0,59-1,00; P=0,026, acima do limiar pré-estabelecido de significância estatística) (PAVEL, 2011).
Análise estatística pré-especificada por IPCW, uma ferramenta que busca corrigir desequilíbrios das características basais e diferentes padrões de censura, sugeriu benefício do everolimo (HR 0,60, IC 95% 0,44-0,84; P=0,001). Diante dos dados desse estudo, oeverolimopassou a ser considerado também no tratamento de TNE não pancreático funcionante em progressão, em especial em segunda linha ou posterior (PAVEL, 2012). No Congresso Europeu de Câncer de 2015 foi apresentado o estudo RADIANT-4, que expandiu as indicações do everolimoaos tumores gastrointestinais não funcionantes. O estudo incluiu 302 pacientes com TNE não funcionante em progressão com sítio primário gastrointestinal ou pulmonar (YAO, 2015). Em randomização 2:1, os doentes foram submetidos a tratamento com everolimo 10 mg/dia ou placebo. A SLP mediana avaliada pela revisão radiológica central, desfecho primário do estudo, foi de 3,9 meses e 11,0 meses nos braços placebo e everolimo, respectivamente (HR 0,48; IC 95% 0,35-0,67; P<0,001) (figura 3). A taxa de controle de doença foi maior no braço experimental (65% versus 82%), ao passo que respostas objetivas foram raras em ambos os grupos (1% versus 2%).
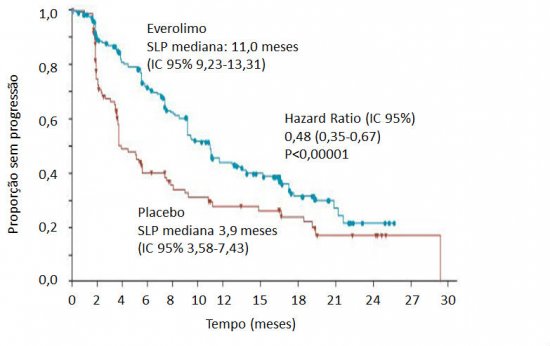
Figura 3. Sobrevida livre de progressão no estudo RADIANT-4. Adaptado de Yao et al, ECC 2015.
O papel da quimioterapia no tratamento do TNE-GEP bem diferenciado continua a ser debatido. As evidências consistem basicamente em pequenos estudos retrospectivos ou de fase II, que comumente avaliam populações heterogêneas. Não há estudos randomizados controlados com placebo, e o impacto da QT na sobrevida livre de progressão ou sobrevida global é incerto. Os regimes mais estudados são baseados em estreptozotocina (que não está disponível no Brasil), temozolomida ou oxaliplatina (STROSBERG, 2015a). Os estudos indicam que o TNE pancreático é sensível à QT, com taxas de resposta que variam de 30% a 70%, o que faz com que o tratamento seja considerado após falha a terapias-alvo ou em pacientes em quem se busca citorredução rápida.
Por outro lado, a sensibilidade do TNE gastrointestinal à QT é desprezível, com TR consistentemente entre 0% e 20%. A indicação de QT nesse grupo de doentes é controversa, e deve ser limitada àqueles doentes que exauriram outras opções terapêuticas (PAVEL, 2012). A maior expressão de Ki-67 parece correlacionar-se com a maior resposta à quimioterapia, embora não existam dados prospectivos que confirmem essa impressão. A deficiência de MGMT, uma enzima de reparo do DNA, é provavelmente um preditor positivo de resposta a agentes alquilantes. Contudo, não há uma padronização da técnica imunoistoquímica de análise de expressão da proteína, assim como não está claro se a análise por imunoistoquímica é superior às técnicas baseadas em PCR que analisam o status de metilação do promotor de MGMT (STROSBERG, 2015a).
Radioisótopos como o lutécio radioativo têm sido utilizados no manejo do TNE-GEP há 20 anos. A maior parte dos estudos retrospectivos e de fase II reportam taxas de resposta de 15% a 35%, com dados de sobrevida que se parecem se comparar favoravelmente com outras modalidades de tratamento. Fatores preditores de resposta ao lutécio são alta captação à cintilografia de receptores de somatostatina, bom performance status e baixo volume tumoral hepático.
A carência de estudos randomizados avaliando o papel dos radioisótopos foi suprida pelo recém-apresentado estudo NETTER-1, que randomizou 230 pacientes com TNE de intestino médio bem diferenciado com progressão após octreotida 20-30 mg e cintilografia de receptores de somatostatina positivo para receber tratamento com 177Lu-Dotatate (lutécio radioativo) por total de quatro aplicações, a cada 8 semanas, associado a octreotida-LAR 30 mg, ou aumento de dose da octreotida-LAR para 60 mg a cada 28 dias (STROSBERG, 2015b). Houve aumento da sobrevida livre de progressão, desfecho primário do estudo, no grupo tratado com lutécio (mediana 8,4 meses versus não atingida; HR 0,20; IC 95% 0,20-0,33; P<0,0001) (figura 4).
A taxa de resposta foi maior no grupo tratado com o radioisótopo (3% versus 19%; P<0,0004). A avaliação de sobrevida global é imatura, mas foram observados menos óbitos no grupo exposto a lutécio (22 versus 13 eventos), ainda que sem significância estatística. Eventos adversos sérios relacionados ao tratamento, normalmente secundários a toxicidade hematológica ou renal, foram descritos em 9% dos pacientes (STROSBERG, 2015b). Os dados do NETTER-1 confirmam os resultados dos estudos anteriores e asseguram à terapia com radioisótopos papel no manejo do TNE com expressão de receptores de somatostatina. Em pacientes com TNE pancreático, o tratamento nuclear não foi avaliado em estudo randomizado. Contudo, a experiência do Erasmus Medical Center indica uma maior taxa de resposta nesse grupo de doentes, quando comparados com pacientes com tumores carcinoides (42,8% versus 22,3%) (KWEKKEBOOM, 2008), o que sugere que a modalidade também deve ser considerada no manejo do TNE-P. Têm sido observados, inclusive em nossa experiência, casos de doentes com TNE-P localmente avançado que se tornaram ressecáveis após tratamento inicial com lutécio radioativo, o que confere à modalidade papel potencialmente curativo no manejo da doença (VAN VLIET, 2015).
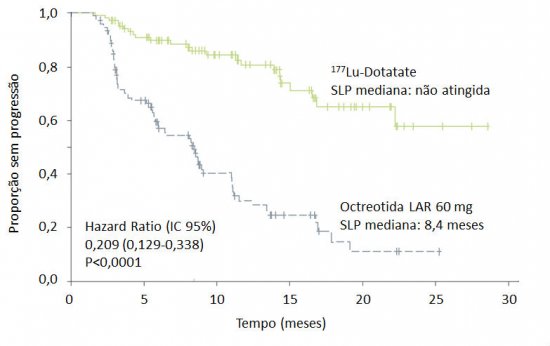
Figura 4. Sobrevida livre de progressão no estudo NETTER-1. Adaptado de Strosberg et al, 2015b.
O melhor momento para indicar o tratamento com lutécio radioativo não está claro. À semelhança dos critérios de inclusão do NETTER-1, e seguindo as recomendações da Sociedade Europeia de Tumores Neuroendócrinos, temos recomendado o emprego de lutécio após falha à terapia medicamentosa. Após progressão com análogo da somatostatina, tanto o uso de lutécio radioativo quanto o de everolimo são sustentados por estudos de fase III em pacientes com tumores de intestino médio.
Há algum receio quanto à toxicidade hematológica tardia em doentes expostos a radioisótopos (BERGSMA, 2015), assim como a um eventual risco de pior tolerância a linhas subsequentes de tratamento, motivos pelos quais alguns especialistas têm preferido usar o lutécio mais tardiamente na evolução da doença. Por outro lado, a toxicidade aguda do lutécio radioativo parece ser de manejo mais fácil do que a dos biológicos.
Uma sugestão de algoritmo de tratamento dos TNE-GEPs está ilustrada na figura 5.
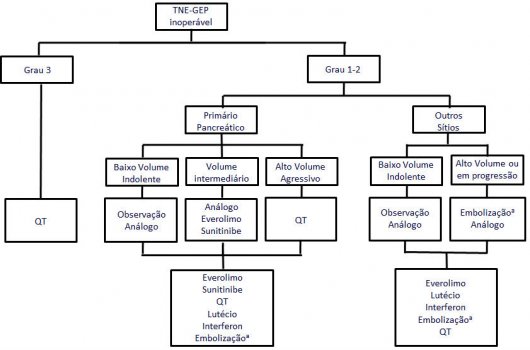
Figura 5. Proposta de algoritmo de manejo dos tumores neuroendócrinos gastroenteropancreáticos (TNE-GEP) localmente avançados ou metastáticos, não passíveis de cirurgia com intuito curativo. aConsiderar embolização em pacientes com doença hepática predominante, especialmente se tumor funcionante.
CONCLUSÃO
TNEs são tumores considerados raros, mas sua incidência tem aumentado ao longo das últimas décadas. A padronização universal da graduação tumoral e da classificação permitiu facilitar a comparação dos resultados de estudos clínicos e o manejo de pacientes com a doença. Exames de imagem morfológica e funcional têm refinado o diagnóstico, estadiamento e avaliação de resposta ao tratamento, mas nenhuma modalidade de imagem isoladamente pode prover todas as informações necessárias. Apesar de sua ampla aplicabilidade, os biomarcadores atualmente utilizados, como a CgA e o 5-HIAA, têm sensibilidade ou especificidade deficiente, e melhores biomarcadores são necessários. Uma combinação racional dos métodos de imagem disponíveis, baseada nos pontos fortes e nas limitações de cada técnica, ajuda a otimizar a avaliação dos pacientes com TNE.
Novas ferramentas diagnósticas e terapêuticas têm emergido nos últimos seis anos como resultado de um esforço contínuo em pesquisa, da uniformização dos critérios diagnósticos, da homogeneização das populações em estudos clínicos e da valorização de SLP como desfecho primário. Isto tem levado a uma melhoria lenta, mas constante nos desfechos clínicos dos pacientes. Apesar dos avanços, questões como a melhor forma de avaliar resposta ao tratamento, de efetuar seleção molecular dos doentes e de definir o sequenciamento das diferentes modalidades de terapia permanecem sem resposta clara.
*Autor: Duílio Reis da Rocha Filho é Chefe do serviço de oncologia clínica do Hospital Universitário Walter Cantídio da Universidade Federal do Ceará, oncologista clínico da Clínica Fujiday, mestre e doutorando em oncologia pelo A.C.Camargo Cancer Center.
REFERÊNCIAS BIBLIOGRÁFICAS
Aparicio T, Ducreux M, Baudin E et al. Antitumour activity of somatostatin analogues in progressive metastatic neuroendocrine tumours. Eur J Cancer 2001;37(8):1014-9.
Bahri H, Laurence L, Edeline J et al. High prognostic value of 18F-FDG PET for metastatic gastroenteropancreatic neuroendocrine tumors: a long-term evaluation. J Nucl Med. 2014; 55(11):1786-90
Bergsma H, Konijnenberg MW, Kam BL et al. Subacute haematotoxicity after PRRT with 177Lu-DOTA-octreotate: prognostic factors, incidence and course. Eur J Nucl Med Mol Imaging. 2015 Sep 30. [Epub ahead of print]
Caplin ME, Pavel M, Ćwikła JB et al. Lanreotide in metastatic enteropancreatic neuroendocrine tumors. N Engl J Med 2014;371(3):224-33.
Jensen RT, Cadiot G, Brandi ML et al. ENETS Consensus Guidelines for the management of patients with digestive neuroendocrine neoplasms: functional pancreatic endocrine tumor syndromes. Neuroendocrinology 2012;95(2):98-119.
Klimstra DS, Modlin IR, Coppola D et al. The pathologic classification of neuroendocrine tumors: a review of nomenclature, grading, and staging systems.Pancreas 2010; 39(6):707-12.
Kwekkeboom DJ, de Herder WW, Kam BL et al. Treatment with the radiolabeled somatostatin analog [177 Lu-DOTA 0,Tyr3]octreotate: toxicity, efficacy, and survival. J ClinOncol2008 ; 26(13):2124-30.
Leung D, Schwartz L. Imaging of neuroendocrine tumors. SeminOncol 2013; 40(1):109-19
Modlin IM, Lye KD, Kidd M. A 5-decade analysis of 13,715 carcinoid tumors. Cancer 2003; 97(4):934-59.
National Comprehensive Cancer Network (NCCN). NCCN Clinical Practice Guidelines in Oncology. NeuroendocrineTumors, Version 1.2015. Disponível em www.nccn.org/professionals/physician_gls/pdf/neuroendocrine.pdf
Oberg K, Modlin IM, De Herder W et al. Consensus on biomarkers for neuroendocrine tumour disease. Lancet Oncol 2015;16(9):e435-46.
Pape UF, Perren A, Niederle B et al. ENETS Consensus Guidelines for the Management of Patients with Neuroendocrine Neoplasms from the Jejuno-Ileum and the Appendix Including Goblet Cell Carcinomas. Neuroendocrinology 2012; 95:135-56.
Pavel ME, Hainsworth JD, Baudin E et al. Everolimus plus octreotide long-acting repeatable for the treatment of advanced neuroendocrine tumours associated with carcinoid syndrome (RADIANT-2): a randomised, placebo-controlled, phase 3 study. Lancet 2011; 378(9808):2005-12.
Rinke A, Müller HH, Schade-Brittinger C et al. Placebo-controlled, double-blind, prospective, randomized study on the effect of octreotide LAR in the control of tumor growth in patients with metastatic neuroendocrine midgut tumors: a report from the PROMID Study Group. J ClinOncol 2009; 27:4656-63.
Rockall AG, Reznek RH. Imaging of neuroendocrine tumours (CT/MR/US). Best Pract Res ClinEndocrinolMetab 2007; 21 (1):43-68.
Saxena A, Chua TC, Perera M et al. Surgical resection of hepatic metastases from neuroendocrine neoplasms: a systematic review. SurgOncol 2012;21(3):e131-41.
Scarpa A, Mantovani W, Capelli P et al. Pancreatic endocrine tumors: improved TNM staging and histopathological grading permit a clinically efficient prognostic stratification of patients. Mod Pathol 2010; 23(6):824-33
Scarpa A, Mantovani W, Capelli P et al. Pancreatic endocrine tumors: improved TNM staging and histopathological grading permit a clinically efficient prognostic stratification of patients. Mod Pathol 2010; 23(6):824-33
Sorbye H, Welin S, Langer SW et al. Predictive and prognostic factors for treatment and survival in 305 patients with advanced gastrointestinal neuroendocrine carcinoma (WHO G3): the NORDIC NEC study. Ann Oncol 2013;24(1):152-60.
Raymond E, Dahan L, Raoul JL et al. Sunitinib malate for the treatment of pancreatic neuroendocrine tumors. N Engl J Med 2011;364:501-513
Strosberg J, Goldman J, Costa F et al. The Role of Chemotherapy in Well-Differentiated Gastroenteropancreatic Neuroendocrine Tumors. Front Horm Res 2015a;44:239-47.
Strosberg J, WolinE,Chasen B et al. 177-Lu-Dotatate significantly improves progression-free survival in patients with mid-gut neuroendocrine tumours: Results of the phase III NETTER-1 trial. European Cancer Congress 2015b, abst 6LBA
van Essen M, Sundin A, Krenning EP et al. Neuroendocrine tumours: the role of imaging for diagnosis and therapy. Nat Rev Endocrinol 2014; 10(2):102-14.
van Vliet EI, van Eijck CH, de Krijger RR et al. Neoadjuvant Treatment of Nonfunctioning Pancreatic Neuroendocrine Tumors with [177Lu-DOTA0,Tyr3]Octreotate. J Nucl Med 2015. pii: jnumed.115.158899. [Epub ahead of print]
Vilar E, Salazar R, Pérez-García J et al. Chemotherapy and role of the proliferation marker Ki-67 in digestive neuroendocrine tumors. EndocrRelat Cancer 2007;14(2):221-32.
Vinik AI, Woltering EA, Warner RP et al. NANETS Consensus Guidelines for the Diagnosis of Neuroendocrine Tumor. Pancreas 2010; 39(6):713-34.
Yao JC, Hassan M, Phan A et al. One hundred years after "carcinoid": epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United States. J ClinOncol 2008;26:3063-3072.
Yao JC, Shah MH, Ito T et al. Everolimus for advanced pancreatic neuroendocrine tumors. N Engl J Med 2011; 364:514-523.
Yao J, Fazio N, Singh S et al. Everolimus in advanced nonfunctional neuroendocrine tumors (NET) of lung or gastrointestinal (GI) origin: Efficacy and safety results from the placebo-controlled, double-blind, multicenter, Phase 3 RADIANT-4 study. EuropeanCancerCongress 2015, abst 5LBA




