 O mastologista Afonso Celso Pinto Nazário (foto), Professor Livre-Docente da Disciplina de Mastologia da Escola Paulista de Medicina da Universidade Federal de São Paulo (EPM-UNIFESP) e Presidente da Comissão Especializada em Mastologia da Federação Brasileira de Ginecologia e Obstetrícia (FEBRASGO); e Vanessa Monteiro Sanvido, mestre e pós-graduanda da Disciplina de Mastologia da EPM-UNIFESP, assinam artigo sobre a drenagem pós-esvaziamento axilar no câncer de mama.
O mastologista Afonso Celso Pinto Nazário (foto), Professor Livre-Docente da Disciplina de Mastologia da Escola Paulista de Medicina da Universidade Federal de São Paulo (EPM-UNIFESP) e Presidente da Comissão Especializada em Mastologia da Federação Brasileira de Ginecologia e Obstetrícia (FEBRASGO); e Vanessa Monteiro Sanvido, mestre e pós-graduanda da Disciplina de Mastologia da EPM-UNIFESP, assinam artigo sobre a drenagem pós-esvaziamento axilar no câncer de mama.
Abstract
{jathumbnail off}Por Vanessa Monteiro Sanvido1, Afonso Celso Pinto Nazário2
O tratamento cirúrgico do câncer de mama evoluiu muito nos últimos anos, com procedimentos com menor morbidade cirúrgica e melhor qualidade de vida. A biópsia do linfonodo sentinela tornou-se o tratamento padrão nos casos iniciais e nas axilas clinicamente negativas, mas a linfonodectomia ainda apresenta papel importante no tratamento. O uso sistemático do dreno de sucção à vácuo pós-linfonodectomia permanece sendo usado por muitos cirurgiões e essa técnica usada indiscriminadamente é causa de desconforto na maioria dos casos.
Palavras-chave: câncer de mama, linfonodectomia, complicações, dreno de sucção
Introdução
O tratamento cirúrgico do câncer de mama invasivo compreende a exérese do tumor com margens através da quandrantectomia ou mastectomia, seguido da avaliação axilar com biópsia do linfonodo sentinela ou linfonodectomia axilar. A linfonodectomia foi considerado durante muito tempo como o tratamento padrão do câncer de mama e assim como o tratamento mamário sofreu evolução nos últimos anos. A cada dia, o tratamento cirúrgico oncológico se torna menos agressivo, buscando baixa morbidade, melhoria da qualidade de vida e resultados estéticos mais satisfatórios.
As principais complicações cirúrgicas do câncer de mama são linfedema, infecção, hematoma, deiscência de ferida operatória, necrose de pele, dor crônica e seroma. A cirurgia mamária normalmente apresenta baixa morbidade e o seroma é a complicação mais frequente com incidência de 15 a 80% dos casos1,2.
Na tentativa de redução da morbidade no pós-operatório, a drenagem sob aspiração contínua tem sido indicada sistematicamente, porém este procedimento não previne a formação do seroma (foto 1, 2 e 3).
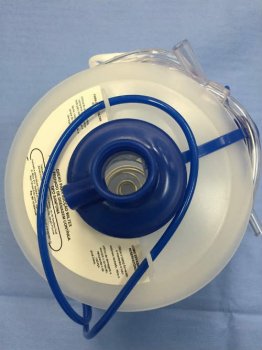
Foto 1. Coletor de aspiração com capacidade de 500 ml. Apresenta cordão de fixação e uma extensão intermediária de PVC.
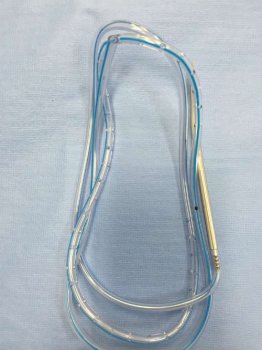
Foto 2. Cateter de drenagem com agulha utilizada para perfurar o local de passagem do dreno. Disponíveis nos tamanhos 3,2mm, 4,8mm e 6,4mm.
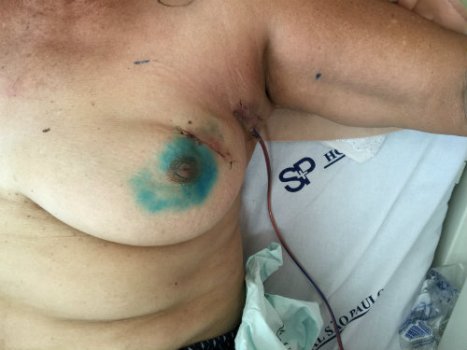
Foto 3. Paciente de 65 anos com diagnóstico de carcinoma mamário invasivo do tipo não especial na mama esquerda T2 N0 MO. Realizada quandrantectomia e biópsia do linfonodo sentinela com técnica do corante azul patente. No intra-operatório foram identificados três linfonodos comprometidos com células neoplásicas, sendo então realizada a linfonodectomia axilar e inserção de dreno de sucção na axila.
(foto no 1o pós-operatório)
O dreno de sucção (foto 1 e 2) é um sistema de drenagem fechado com aspiração constante que utiliza uma leve sucção à vácuo e assim facilita a drenagem. É usado em cirurgias com secreção serosa ou sanguinolenta, como por exemplo as cirurgias mamárias (foto 3).
Metanálise de 2006 avaliou os fatores de risco para a formação de seroma e os principais fatores foram a obesidade, a mastectomia radical e o maior volume de drenagem nos 3 primeiros dias de pós-operatório, com nível de evidência moderada. Não foram significativos para a formação do seroma o tempo do uso do dreno, a intensidade da pressão negativa da drenagem, o número de drenos utilizados, o dia de retirada do dreno (quinto dia do pós-operatório versus quando o volume drenado diariamente estava baixo) e a imobilização do membro superior. Entretanto, houve redução significativa do seroma nas pacientes que realizaram biópsia do linfonodo sentinela3.
O seroma é uma complicação menor, mas pode prolongar a permanência hospitalar, atrasar a terapia adjuvante e afetar a cicatrização2. O uso do dreno está associado a drenagem do seroma e consequentemente menor risco de infecção, melhor cicatrização e redução da dor no pós-operatório.
A drenagem axilar foi introduzida por Murpy em 1947 e desde então vem sendo usada rotineiramente para reduzir o seroma após a dissecção axilar4. Recentes artigos questionam o real benefício da drenagem e os resultados na literatura são controversos. Entretanto, será que o uso do dreno de sucção dever ser usado de forma indiscriminada? Estaria o dreno associado a complicações na cicatrização, dor e desconforto nas atividades cotidianas da paciente?
Desenvolvimento
Revisão sistemática publicada em 2011 avaliou o benefício do dreno de sucção após linfonodectomia axilar no carcinoma de mama. O estudo incluiu 6 ensaios clínicos randomizados, comparando drenagem axilar versus ausência do uso do dreno, totalizando 585 pacientes. Os resultados demonstraram que a inserção do dreno na axila reduziu significativamente a taxa de seroma (Odds Ratio - OR = 0,36, IC 95% 0,16 a 0,81, p = 0,01), o volume de aspiração (média da diferença - MD = - 100,10, IC 95% - 174,36 a - 25,85, p = 0,008) e a frequência de aspiração de seroma (MD = - 1,03, IC 95% - 1,35 a - 071, p , 00001) mas prolongou a internação hospitalar (MD = 1,52, IC 95% 0,36 a 2,68, p = 0,01). A incidência de seroma foi alta, 46,8% no grupo que fez uso do dreno e 68,8% no que não realizou drenagem (p<0,001). Não houve diferença significativa na incidência de infecção nos dois grupos (OR = 0,67, IC 95% 0,34 a 1,32, p =0,25)2. Baseado nesse estudo, a inserção do dreno na axila após linfonodectomia axilar no câncer de mama diminuiu com eficácia o seroma, o volume de aspiração, a frequência de aspiração, sem aumentar a taxa de infecção no pós-operatório2.
Revisão da Cochrane em 2013 avaliou os efeitos da drenagem após a linfonodectomia axilar no câncer de mama. Foram incluídos 7 ensaios clínicos randomizados, totalizando 960 pacientes, que compararam uso do dreno versus ausência do dreno em pacientes que realizaram quandrantectomia ou mastectomia com dissecção axilar, sendo excluídas da análise as pacientes que realizaram somente a biópsia do linfonodo sentinela5. O uso do dreno foi associado com menores taxas de seroma (OR 0,46, IC 95% 0,23 a 0,91, p=0,03) e redução do número de aspiração (OR 0,79, IC 95% 1,23 a 0,35, p = 0,0004). Não houve diferença significativa na taxa de infecção (OR 0,70, IC 95% 0,44 a 1,12, p=0,14), na incidência de linfedema (OR 2,31, IC 95% 0,47 a 11,37, p =0,30) e na incidência de hematoma (OR 1,68, IC 95% 0,33 a 8,51, p = 0,53)5. Entretanto, a qualidade dos estudos analisados foi consideradabaixa, com risco de viés de seleção e a maioria não foi randomizadadurante o tratamento. Além disso, houve um alto nível de variação estatística entre os artigos o que pode reduzir a confiabilidade dos resultados5.
Não há dúvida que os pacientes sem dreno no pós-operatório de linfonodectomia apresentam maiores taxas de seroma, no entanto, alguns estudos questionam se essa prática aumentaria a dor e causaria prejuízo da qualidade de vida.
Quando retirar o dreno?
1. Débito do dreno x duração do uso
Uma pesquisa com 4.669 cirurgiões da American Society of Plastic Surgeons e Canadian Society of Plastic Surgeons identificou que 86% dos participantes utilizam como parâmetro para remover o dreno o débito menor que 30 ml em 24 horas6.
Alguns estudos enfatizam a retirada precoce do dreno independente do débito diário com o objetivo de reduzir a hospitalização prolongada, porém isso não é um problema no nosso país, uma vez que as pacientes recebem alta com o dreno e são orientadas a ter o próprio manuseio em domicílio. Entretanto, a retirada precoce teria outras vantagens, como o retorno precoce das atividades diárias e a diminuição da dor no local da inserção do mesmo.
De acordo com Barwel et al, após 48 horas da cirurgia 74% do volume total do seroma já foi drenado e não há diferença em se permanecer com a drenagem 7. Kopelman et al observaram que é seguro a remoção precoce do dreno em 72 horas do pós-operatório, desde que o volume total de débito seja inferior a 250 ml neste período8.
Estudo de Parikh et al com 100 pacientes que realizaram mastectomia com linfonodectomia axilar não identificou diferença no volume de seroma, número de aspirações e consultas médicas entre o grupo que retirou o dreno no 3o versus 6o dia de pós-operatório9. Estudo similar não encontrou diferença estatística entre a retirada do dreno em 48 horas versus débito inferior a 30 ml em 24 horas10.
2. Infecção x duração do uso
Estudo prospectivo com 354 mulheres com câncer de mama que receberam tratamento cirúrgico com uso rotineiro do dreno axilar demonstrou que a probabilidade de colonização bacteriana no dreno foi de 33% no 7o pós-operatório (PO) e 80,8% no 14o PO. A taxa de infecção do sítio cirúrgico (ISC) foi de 17% e a colonização bacterina do dreno (p=0,03) foi um fator independente associado a aumento da incidência de infecção pós-operatória11. O estudo sugere que a remoção precoce do dreno no 3o pós-operatório pode prevenir infecção.
Além disso, o uso prolongado do dreno (acima de 21 dias) pode representar uma fonte independente de infecção e até mesmo retardar a cicatrização. A remoção precoce foi associada a menores complicações e melhores resultados cicatriciais12.
A taxa de infecção com o uso do dreno é consideradabaixa e as diretrizes atuais não recomendam o uso de antibiótico profilático13.
Desejo da paciente e desconforto em relação ao dreno
Estudo descritivo transversal avalioua dificuldade para a realização de atividades diárias e os sentimentos negativos desencadeadospelo dreno de sucção em mulheres com câncer de mama submetidas a tratamento cirúrgico que permaneceram com dreno por pelo menos três dias. Houve limitação das atividades diárias em 68,8% das pacientes, 79% relataram dificuldades com a vestimenta e 87% prejuízo para dormir. Entre os sentimentos foram referidos 76% de sensação estranha, 72% de medo e 71% de insegurança14.
Conclusão
O cirurgião pode individualizar e considerar o uso do dreno de sucção pós-linfonodectomia axilar no câncer de mama, porém, não deve ser usado rotineiramente. A avaliação caso a caso, permite a identificação das pacientes nas quais a drenagem pode ser dispensável. O uso do dreno está associado a menor morbidade cirúrgica pela redução da incidência de seroma e menor número de aspirações, às custas do aumento do desconforto local e das dificuldades diárias. A remoção precoce do dreno após 72 horas é uma prática aceitável e segura independente do débito diário, assegurando baixas taxas de infecção e retorno mais rápido às atividades habituais.
Autores
1: Vanessa Monteiro Sanvido - Mastologista, Mestre e Pós-graduanda da Disciplina de Mastologia da Escola Paulista de Medicina da Universidade Federal de São Paulo (EPM-UNIFESP). Preceptora dos Residentes da Disciplina de Mastologia da Escola Paulista de Medicina da Universidade Federal de São Paulo (EPM-UNIFESP).
2: Afonso Celso Pinto Nazário - Professor Livre-Docente da Disciplina de Mastologia da Escola Paulista de Medicina da Universidade Federal de São Paulo (EPM-UNIFESP). Presidente da Comissão Especializada em Mastologia da Federação Brasileira de Ginecologia e Obstetrícia (FEBRASGO).
Referências
1. Platt R, Zucker JR, Zaleznik DF, Hopkins CC, Dellinger EP, Karchmer AW, et al. Perioperative antibioticprophylaxisandwoundinfectionfollowingbreastsurgery. J AntimicrobChemother 1993;31(Suppl B):43–8.
2. He XD, Guo ZH, Tian JH, Yang KH, Xie XD. Whether drainage should be used after surgery for breast cancer? A systematic review of randomized controlled trials.Med Oncol. 2011 Dec;28 Suppl1:S22-30.
3.Kuroi K, Shimozuma K, Taguchi T, Imai H, Yamashiro H, Ohsumi S, et al. Evidence-based risk factors for seroma formation in breast surgery. Jpn J ClinOncol. 2006 Apr;36(4):197-206.
4.Moss JP. Historical and current perspectives on surgical drainage.SurgGynecol Obstet. 1981 Apr;152(4):517-27.
5. Thomson DR, Sadideen H, Furniss D. Wound drainage after axillary dissection for carcinoma of the breast. Cochrane Database Syst Rev. 2013 Oct 20;10:CD006823
6. Phillips BT, Wang ED, Mirrer J, Lanier ST, Khan SU, Dagum AB, et al. Current practice among plastic surgeons of antibiotic prophylaxis and closedsuction drains in breast reconstruction: experience, evidence, and implications for postoperative care. Ann Plast Surg. 2011 May;66(5):460-5
7. Barwell J, Campbell L, Watkins RM, Teasdale C. How long should suction drains stay in after breast surgery with axillary dissection? Ann R Coll SurgEngl. 1997 Nov;79(6):435-7.
8. Kopelman D, Klemm O, Bahous H, Klein R, Krausz M, Hashmonai M.Postoperative suction drainage of the axilla: for how long? Prospective randomised trial Eur J Surg. 1999 Feb;165(2):117-20
9.Parikh HK, Badwe RA, Ash CM, Hamed H, Freitas R Jr, Chaudary MA, et al.Early drain removal following modified radical mastectomy: a randomized trial. J SurgOncol1992;51:266–269.
10.Yii M, Murphy C, Orr N. Early removal of drains and discharge of breast cancer surgery patients: a controlled prospective clinical trial. Ann R CollSurg Engl. 1995;77(5):377–379.
11.Felippe WA, Werneck GL, Santoro-Lopes G.Surgical site infection among women discharged with a drain in situ after breast cancer surgery. World J Surg. 2007;31(12):2293–2299.
12. Hanna KR, Tilt A, Holland M, Colen D, Bowen B, Stovall M, et al. Reducing Infectious Complications in Implant Based Breast Reconstruction: Impact of Early Expansion and Prolonged Drain Use. Ann Plast Surg. 2016 Feb 24.
13. Chim JH, Borsting EA, Thaller SR. Urban Myths in Plastic Surgery: Postoperative Management of Surgical Drains. Wounds. 2016;28(2):3539.
14. Junior RF, Cavalcante AFS, Soares LR, Padua APQ, Sousa PTP, Ribeiro LFJR, et al. Estudo comportamental sobre a drenagem axilar no câncer de mama. RevBras Mastologia. 2014; 24(2):42-46.




