 Em artigo exclusivo, Drielle Zanuncio Omido Araujo e Rubens Chojniak (foto), médicos radiologistas do Departamento de Imagem do Hospital A.C.Camargo Cancer Center, fazem uma revisão das indicações, limitações, técnicas e interpretação dos exames de imagem no diagnóstico e estadiamento do câncer de próstata.
Em artigo exclusivo, Drielle Zanuncio Omido Araujo e Rubens Chojniak (foto), médicos radiologistas do Departamento de Imagem do Hospital A.C.Camargo Cancer Center, fazem uma revisão das indicações, limitações, técnicas e interpretação dos exames de imagem no diagnóstico e estadiamento do câncer de próstata.
Resumo
{jathumbnail off}O câncer de próstata é o câncer mais incidente na população masculina, excluindo-se o câncer de pele não-melanoma. O rastreamento é baseado na dosagem do antígeno prostático específico (PSA) e no exame digital retal, e o diagnóstico realizado através da biópsia guiada por ultrassonografia transretal (USTR).
Cada vez mais a ressonância magnética (RM) está sendo utilizada para refinar a detecção e o estadiamento do câncer de próstata. O exame de ressonância magnética combina sequências morfológicas, ponderadas em T1 e T2, e sequências funcionais, como a Difusão e a Permeabilidade, sendo o melhor método para a localização do tumor antes da biópsia e para o estadiamento locorregional. Este artigo tem o objetivo de revisar as indicações, limitações, técnicas e interpretação dos exames de imagem no diagnóstico e estadiamento do câncer de próstata.
Palavras-chave: câncer de próstata, diagnóstico, estadiamento, ultrassonografia transretal, ressonância magnética.
Introdução
O câncer de próstata é o câncer mais incidente na população masculina, excluindo-se o câncer de pele não-melanoma, e a segunda causa de morte relacionada a câncer nesta população. Estimam-se 61.200 casos novos de câncer de próstata para o Brasil em 2016, correspondendo a um risco estimado de 61,82 casos novos a cada 100 mil homens.1
O diagnóstico do câncer de próstata é tradicionalmente realizado através da dosagem do antígeno prostático específico (PSA) sérico, no exame digital retal, e na biópsia guiada por ultrassonografia transretal (USTR). Entretanto, o PSA, apesar de sensível, tem baixa especificidade, em torno de 36%, e um PSA sérico normal também não exclui o câncer de próstata. O toque retal, por sua vez, apresenta alta especificidade, de até 90%, porém baixa sensibilidade (48 a 59%).2,3
O diagnóstico definitivo é realizado por meio da biópsia guiada por USTR, que é feito de forma randômica. Desta forma, alguns tumores podem não ser amostrados na biópsia, principalmente aqueles localizados na região anterior e apical da próstata. O valor preditivo negativo da biópsia randômica guiada por USTR é de 70 – 80%.4,5
Neste contexto, os exames de imagem têm sido crescentemente utilizados como meio de refinar a diagnóstico do câncer de próstata e seu estadiamento locorregional. Os exames mais indicados para a avaliação prostática são a ultrassonografia e a ressonância magnética. Dentre essas modalidades, a ressonância magnética (RM) se destaca, com performance muito superior.6
Este artigo tem o objetivo de revisar as indicações, limitações, técnicas e interpretação dos exames de imagem no diagnóstico e estadiamento do câncer de próstata.
Ultrassonografia da próstata
A ultrassonografia suprapúbica não tem indicação no contexto de neoplasia prostática, devendo ser reservada apenas para a medida do volume da próstata e do resíduo pós-miccional em pacientes com suspeita de hiperplasia prostática benigna (HPB).4
A ultrassonografia transretal, realizada através de transdutores endocavitários, permite uma melhor definição da anatomia prostática, diferenciando a zona periférica, que é hiperecogênica, das zonas central e de transição, que são hipoecogênicas.4
Cerca de 60 – 70% dos tumores da zona periférica são hipoecogênicos em relação ao restante da próstata (fig. 1), entretanto apenas 17 – 57% dos focos hipoecogênicos representam câncer. Causas benignas como atrofia ou prostatite se apresentam de forma semelhante no ultrassom transretal. Além disso, 30 a 40% dos tumores são isoecogênicos, indistinguíveis do parênquima prostático normal. A USTR em pacientes sem alterações ao toque retal apresenta sensibilidade de apenas 30-45%.7,8
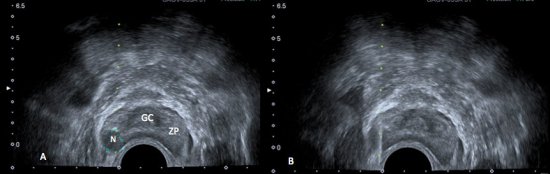
Figura 1. A) Ultrassonografia transretal da próstata demonstrando a anatomia prostática: glândula central (GC) discretamente hipoecogênica, e a zona periférica (ZP), mais ecogênica. Nota-se nódulo (N) bem delimitado, hipoecogênico, na zona periférica. B) Biópsia transretal da próstata.
Devido à baixa acurácia do USTR para a detecção do câncer de próstata, e ao custo deste exame, as diretrizes da Sociedade Americana de Câncer e do Centro de Controle e Prevenção de Doenças não recomendam o uso do USTR no rastreamento inicial, devendo ser reservado apenas para os casos que necessitem de biópsia.8
Biópsia transretal da próstata guiada por ultrassom
A biópsia transretal da próstata é geralmente indicada nos casos de elevação do PSA e/ou alteração no toque retal. É realizada de forma randômica, dividindo a próstata em sextantes, sendo preconizado o mínimo de 12 fragmentos. Áreas suspeitas na ultrassonografia devem ser adicionalmente amostradas. É um procedimento relativamente simples, com baixas taxas de complicações, sendo o risco de infeção e sangramento de 0 – 4 % e 1,3 – 5,8%, respectivamente. Contraindicações à biópsia transretal incluem ausência cirúrgica do reto, doença intestinal inflamatória, infecção/abscesso perianal, e diáteses hemorrágicas.4
A biópsia guiada por USTR apresenta alta especificidade, porém com sensibilidade limitada, apresentando valor preditivo negativo de cerca de 70 – 80%. Isto ocorre pois alguns tumores podem não ser amostrados na biópsia, principalmente aqueles localizados na região anterior ou apical da próstata.4,9Pacientes com suspeita de resultado falso-negativo representam um desafio, uma vez que o rendimento diagnóstico de biópsias subsequentes é cada vez menor.
Por último, tendo em vista que o câncer de próstata é multifocal em até 85 % dos casos, biópsias guiadas por USTR podem subestimar a extensão e a gravidade do câncer, não sendo raro o aumento no escore de Gleason após a prostatectomia.10
Quando a RM da próstata é realizada antes da biópsia, é recomendada a amostragem adicional de áreas suspeitas à RM, abordagem conhecida como biópsia transretal dirigida. Softwares recentes permitem a fusão das imagens da RM com a ultrassonografia em tempo real, garantindo assim que as áreas suspeitas sejam biopsiadas. Estudos demonstram que a biópsia dirigida ou com fusão apresentam até 3 vezes mais chance de identificar câncer do que a biópsia randomizada 9,10.
Ressonância magnética
A RM é um método de imagem que não envolve radiação ionizante e permite obtenção de imagens com alta resolução espacial e excelente contraste de partes moles, superior a qualquer outra modalidade na avaliação prostática.11
Indicações
Cada vez mais a RM tem sido indicada antes da biópsia, geralmente em pacientes com alteração do PSA ou do toque retal, com o objetivo de indicar as áreas suspeitas para neoplasia, que deverão ser adicionalmente amostradas na biópsia transretal. Esta abordagem possibilita o aumento da detecção de neoplasias clinicamente significantes, e diminui o número de resultados falso-negativos da biópsia. Está especialmente indicada naqueles pacientes com alta suspeita clínica e biópsias anteriores negativas.10,12
A RM da próstata também pode ser usada em conjunto com dados clínicos e laboratoriais para a seleção dos pacientes para a biópsia, devido ao seu alto valor preditivo negativo para tumores clinicamente significantes, definido por volume maior que 0,5 cm³, escore de Gleason ≥ 7, e/ou extensão extraprostática.11
A RM é ainda o melhor método de imagem para o estadiamento locoregional do câncer de próstata, permitindo a identificação de extensão extra-capsular, envolvimento dos feixes neurovasculares e das vesículas seminais, além de avaliar a presença de linfonodomegalias pélvicas.13
A RM tem limitações em tumores pequenos (< 0,5 cm3) e em tumores de baixo grau (Gleason < 6), porém a importância do diagnóstico destes tumores é incerta.13
Técnica
O exame deve ser realizado em aparelhos de alto campo (1,5 ou 3 Teslas), com bobina de superfície na pelve. O uso da bobina endorretal associado é fonte de discussões. A bobina endorretal permite uma maior relação sinal – ruído, melhorando a resolução espacial, característica especialmente útil nos exames de estadiamento. Entretanto seu uso aumenta o custo e o tempo do exame, promove artefatos nas imagens, e causa desconforto no paciente, sendo recomendado levar todos estes fatores em consideração. Imagens satisfatórias têm sido obtidas em aparelhos de 1,5 e 3T sem a bobina endorretal, sendo seu uso relegado hoje em dia em muitos casos.14
Recomenda-se que a RM seja realizada pelo menos 6 semanas após uma biópsia transretal da próstata, visto que sangramento e inflamação após o procedimento podem prejudicar a avaliação prostática, principalmente nos exames de estadiamento. Porém, estudos recentes têm demonstrado que a detecção de tumores clinicamente significantes não é substancialmente comprometida por hemorragia pós-biópsia, não sendo necessário postergar a realização da RM se o objetivo principal do exame é o diagnóstico.14
Atualmente os exames combinam técnicas funcionais às sequências morfológicas ponderadas em T1 e T2, abordagem que recebe o nome de Ressonância Magnética Multiparamétrica da próstata.15
PI-RADS
A aplicação da RM para o estudo da próstata é muito recente, e a padronização das técnicas de aquisição da imagem, bem como da interpretação e relato dos achados, só ocorreu em 2012, com a publicação do PI-RADS (Prostate Imaging Reporting and Data System) pela Sociedade Europeia de Urorradiologia (ESUR - European Society of Uroradiology)2, o que foi fundamental para melhorar a comunicação e aumentar a aceitação da RM de próstata. Mais recentemente, em 2015, foi publicado o PI-RADS v2 14, em um esforço conjunto da ESUR, do Colégio Americano de Radiologia, e da AdMeTech Foundation, visando diminuir as limitações da primeira versão, e abranger os novos conceitos na interpretação do exame.14,16,17
O PI-RADS preconiza uma escala de pontos que traduz a probabiliade de que uma lesão prostática represente um câncer clinicamente significante, na dependência de suas características de imagem em T2, Difusão, e estudo contrastado dinâmico (tabela 1).
Tabela 1. Classificação de PI-RADS, conforme proposto no Prostate Imaging Reporting and Data System 2.0, do Colégio Americano de Radiologia e da Sociedade Europeia de Urorradiologia.
| PI-RADS 1 | Muito baixa probabilidade de tumor clinicamente significante |
| PI-RADS 2 | Baixa probabilidade de tumor clinicamente significante |
| PI-RADS 3 | Probabilidade intermediária para tumor clinicamente significante |
| PI-RADS 4 | Alta probabilidade de tumor clinicamente significante |
| PI-RADS 5 | Muito alta probabilidade de tumor clinicamente significante |
Ele não contempla a indicação ou não de biópsia da próstata, pois esta avaliação depende da correlação com outros dados clínicos e laboratotoriais, como o valor do PSA e o exame digital retal. Entretanto, a biópsia deve ser sempre considerada em pacientes com PI-RADS 4 ou 5.14
Avaliação morfológica – T1 e T2.
Pelo menos uma sequência ponderada em T1 deve ser realizada em todo exame da próstata para a avaliação de hemorragia prostática, caracterizada por focos de hipersinal. (fig. 2). Geralmente esta sequência é realizada com um maior campo de visão, permitindo a pesquisa de linfonodomegalias pélvicas e metástases nos ossos da bacia.15
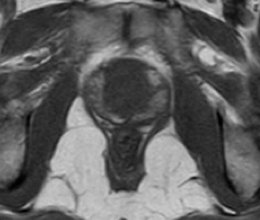
Figura 2.Imagem de RM ponderada em T1, demonstra hipersinal em praticamente toda a zona periférica da próstata, compatível com sangramento pós-biópsia transretal.
Sequências multiplanares ponderadas em T2 são fundamentais para o estudo da próstata, pois apresentam a maior resolução espacial e de contraste, permitindo avaliação detalhada da anatomia prostática. Nas imagens pesadas em T2, a zona periférica normal tem hipersinal homogêneo, apresentando-se em formato de “crescente” no plano axial. As zonas transicional, central e periuretral, dificilmente diferenciadas por métodos de imagem são, em conjunto, denominadas glândula central ou glândula interna, e exibem intensidade de sinal intermediária em T2. O limite entre a zona periférica e a glândula central é denominado “cápsula cirúrgica”, e a camada fibromuscular descontínua que recobre a glândula, “cápsula prostática”.11(fig. 3).
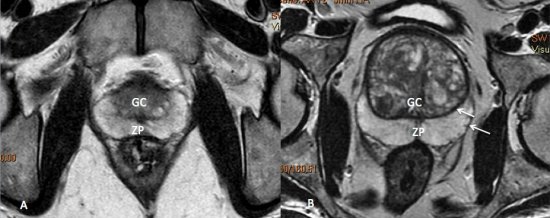
Figura 3. Imagens de RM ponderadas em T2 demonstrando a anatomia prostática. A) Próstata normal. A zona periférica (ZP) exibe hipersinal homogêneo, e a glândula central (GC) apresenta sinal intermediário. B) Hiperplasia prostática benigna. Observe o aumento significativo das dimensões da glândula central (GC), que exibe sinal heterogêneo e aspecto nodular. O limite entre a zona periférica e a glândula central é denominado cápsula cirúrgica, e linha de baixo sinal circundando a próstata é denominada cápsula prostática (setas).
Na zona periférica da próstata, os tumores clinicamente significantes usualmente se apresentam como nódulo ou área mal definida de baixo sinal nas imagens ponderadas em T2. (fig. 4).
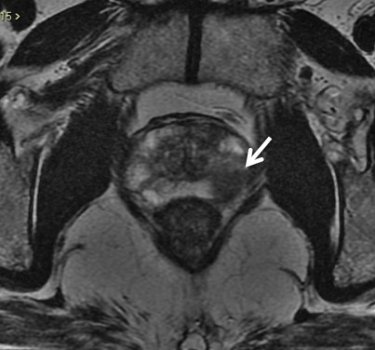
Figura 4. Imagem axial de RM da próstata ponderada em T2. Nódulo bem delimitado com baixo sinal na zona periférica esquerda, de alta probabilidade de neoplasia clinicamente significativa.
Este achado tem alta sensibilidade na detecção de câncer de próstata com valores de Gleason de 7 ou mais, porém não é específico, e pode ser encontrado em diversas condições, como prostatite, hemorragia, atrofia, cicatrizes e pós-tratamentos.15
O diagnóstico de câncer de próstata na glândula central é um desafio, dada a heterogeneidade da região, e o amplo espectro de alterações relacionadas a hiperplasia prostática benigna. Pode-se suspeitar de tumores de glândula central pela presença de área homogeneamente hipointensa em T2, com margens mal definidas ou espiculadas, de forma lenticular, ou quando está associado a indefinição da cápsula cirúrgica, invasão da uretra ou do estroma fibromuscular anterior.15
No estadiamento locorregional do câncer de próstata, o aspecto mais relevante na tomada de decisão terapêutica é a diferenciação entre tumor confinado ao órgão (T1 e T2) e tumor localmente avançado, sob as formas de extensão extracapsular (T3a) ou invasão de vesículas seminais (T3b). Para esta avaliação, as imagens ponderadas em T2 são as mais indicadas15,18(fig. 5 e 6).
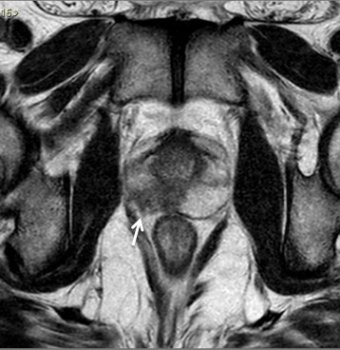
Figura 5. Estadiamento de adenocarcinoma de próstata Gleason 7. Imagem ponderada em T2 evidencia nódulo no terço médio da zona periférica direita, notando-se pequena irregularidade da cápsula prostática adjacente à lesão, sugestivo de extensão extra-capsular.
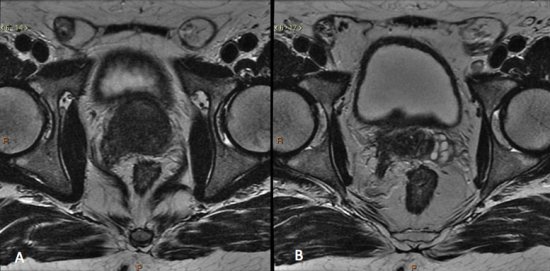
Figura 6. Estadiamento de adenocarcinoma da próstata Gleason 9. A) Lesão hipointensa comprometendo quase toda a glândula, com extensão para a gordura periprostática à direita. B) Comprometimento das vesículas seminais.
Os critérios de imagem para extensão extracapsular incluem assimetria ou envolvimento macroscópico dos feixes neurovasculares, abaulamento focal do contorno prostático, espiculação ou irregularidade do contorno prostático, obliteração do ângulo retoprostático, retração capsular, e sinais de rotura capsular com extensão direta a gordura periprostática. Lesões que exibem contato maior que 1,0 cm com a cápsula prostática apresentam maior risco de extensão extracapsular.15,18
Os achados que indicam invasão das vesículas seminais incluem: aumento de tamanho, assimetria e hipointensidade das vesículas seminais, obliteração do ângulo vesicoprostático e extensão direta da base prostática à vesícula seminal, sendo este achado o de maior valor preditivo positivo.15,18
Difusão
A Difusão (DWI - Diffusion weighted imaging) estuda o movimento randômico das moléculas de água nos tecidos, estimando indiretamente a densidade celular e a viabilidade das membranas celulares. A sequência gera múltiplos conjuntos de imagens, de acordo com o número de fatores de difusão ou “valores de b” escolhidos. O aparelho também gera um mapa de coeficiente de difusão aparente (ADC – apparent diffusion coefficient), que é um conjunto de imagens que permite a quantificação das propriedades de difusão. Desta forma, uma lesão com difusibilidade restrita aparece como uma área hiperintensa no DWI, e com redução da intensidade de sinal no mapa ADC.11
A restrição à difusão das moléculas de água no câncer de próstata é atribuída ao aumento da celularidade das lesões malignas, com redução do espaço extracelular, e consequente restrição à livre movimentação das moléculas de água. Portanto, a DWI tem o potencial de diferenciar lesões benignas de malignas, sendo fundamental na detecção do câncer de próstata.13,19(fig. 7).
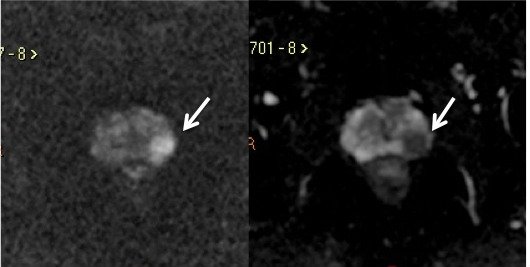
Figura 7. Mesmo paciente da figura 4, imagem ponderada em Difusão (A) e o mapa de ADC (B) mostram lesão na zona periférica esquerda, com intensa restrição à difusão das moléculas de água, caracterizado por hipersinal no DWI e baixo sinal no mapa de ADC.
Em uma metanálise recente, a DWI isolada apresentou sensibilidade de 62% e especificidade de 90% no diagnóstico do câncer de próstata. A sensibilidade é maior quanto maior o volume tumoral e o escore de Gleason. É importante ainda ressaltar que a sensibilidade da difusão para a detecção do câncer de próstata é muito maior na zona periférica, em torno de 79%.19A DWI é limitada na avaliação da glândula central, já que nódulos de hiperplasia prostática podem apresentar restrição variável à difusão. Para tumores da glândula central, as imagens ponderadas em T2 parecem ter melhor capacidade de detecção do câncer do que a difusão.14
Estudos têm demonstrado ainda que os valores de ADC têm forte correlação com a agressividade tumoral, sendo que tumores com escore de Gleason maior apresentam valores de ADC mais baixos. Portanto, além do diagnóstico, a Difusão fornece informações relativas ao prognóstico.11
Limitações da DWI incluem baixa resolução espacial e maior risco de degradação das imagens por artefatos de susceptibilidade magnética. Devido à baixa resolução espacial, a difusão é limitada para o estadiamento locorregional, sendo as imagens ponderadas em T2 fundamentais para esta avaliação.11
Estudo contrastado dinâmico
O estudo contrastado dinâmico (DCE - dynamic contrast enhanced) ou permeabilidade é uma modalidade avançada de imagem que avalia as propriedades microvasculares e de angiogênese nos tecidos. O DCE é baseado em sequências pesadas em T1 que são repetidamente obtidas antes, durante e após a administração do contraste endovenoso. As imagens são então pós-processada, com avaliação semiquantitativa ou quantitativa, permitindo a produção de mapas coloridos e curvas de realce. O contraste utilizado na RM é o quelato de gadolínio, agente que apresenta risco de reação alérgica significativamente menor do que o contraste iodado, porém é contraindicado em pacientes com insuficiência renal grave, devido ao risco de fibrose nefrogênica sistêmica. 6
Tumores malignos em geral, incluindo o câncer de próstata, apresentam classicamente um realce intenso e precoce após a administração do meio de contraste (wash-in), seguido de lavagem precoce do mesmo (wash-out), em comparação aos tecidos normais (fig. 8). Entretanto, na prática, a cinética de realce do câncer de próstata é variável, com uma porcentagem significativa dos casos não apresentando este padrão de impregnação.15
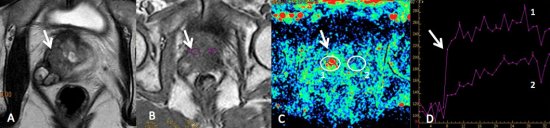
Figura 8. A) Imagem de RM ponderada em T2, mostra lesão com hipossinal, mal delimitada, na zona periférica direita, com extensão extra-capsular. B, C e D) Estudo contrastado dinâmico da próstata. B) Imagem ponderada em T1 com a topografia dos ROIs (Regions of Interest) nas zonas periféricas direita e esquerda. C) Mapa de cores, demonstrando área com aumento da permeabilidade na zona periférica direita, representada em vermelho. D) Gráfico intensidade de sinal x tempo da permeabilidade. Observe a ascensão rápida da curva 1 (wash-in), seguido de platô, e a ascensão lenta e progressiva da curva 2, zona periférica normal à esquerda.
Atualmente, a importância do DCE não está bem estabelecida, e vários estudos estão demonstrando que adiciona pouca informação ao exame realizado apenas com T2 e DWI. 20Na padronização proposta pelo PI-RADS, o DCE não contribui para a categorização da lesão quando ela já apresenta baixa ou alta probabilidade de câncer clinicamente significante pelo T2 e DWI. Entretanto, nos casos de probabilidade intermediária (PI-RADS 3), um DCE positivo aumenta a chance de que este achado represente um câncer significante, devendo-se aumentar a classificação para 4.14
Conclusão
Exames de imagens têm sido cada vez mais utilizados no contexto do câncer de próstata, com destaque para a ressonância magnética, que tem papel estabelecido na detecção tumoral, indicação de áreas suspeitas para biópsia, estadiamento locorregional e planejamento terapêutico. Grandes estudos estão em andamento para correlacionar os achados da RM com a evolução clínica a longo prazo e seguimento de pacientes tratados ou em vigilância ativa. A ultrassonografia transretal da próstata apresenta papel limitado na avaliação prostática, devendo ser reservada para os casos que necessitem de biópsia transretal.
Autores:
Drielle Zanuncio Omido Araujo é médica radiologista do Departamento de Imagem do Hospital A.C.Camargo Cancer Center
Rubens Chojniak é médico radiologista, titular e diretor do Departamento de Imagem do A.C.Camargo Cancer Center. Mestre e Doutor em Oncologia pela Fundação Antônio Prudente.
BIBLIOGRAFIA
1. Instituto Nacional de Câncer José Alencar Gomes da Silva. Estimativa 2016 – Incidência de câncer no Brasil. Disponível em: www.inca.gov.br.
2. Barentsz JO, Richenberg J. UROGENITAL ESUR prostate MR guidelines 2012. 2012:746-757. doi:10.1007/s00330-011-2377-y.
3. Cabria RO, Semino MA, Bañez ET, et al. Estudio estadístico de probabilidades del tacto rectal , PSA total , densidad del PSA en el cáncer de próstata . 2002;1:35-40.
4. Harvey CJ, Pilcher J, Richenberg J, Patel U, Frauscher F. Applications of transrectal ultrasound in prostate cancer. 2012;85:3-17. doi:10.1259/bjr/56357549.
5. Costa DN, Pedrosa I, Donato F, Roehrborn CG, Rofsky NM. MR Imaging–Transrectal US Fusion for Targeted Prostate Biopsies: Implications for Diagnosis and Clinical Management. RadioGraphics. 2015;35(3):696-708. doi:10.1148/rg.2015140058.
6. Bittencourt LK, Hausmann D, Sabaneeff N, Gasparetto EL, Barentsz JO. Ressonância magnética multiparamétrica da próstata : 2014;47(5):292-300. doi:10.1590/0100-3984.2013.1863.
7. Neural A, Analysis N. Role of Transrectal Ultrasonography. 2006:815-821.
8. Postema A, Mischi M, De J. Multiparametric ultrasound in the detection of prostate cancer : a systematic review. World J Urol. 2015:1651-1659. doi:10.1007/s00345-015-1523-6.
9. Hwang S Il, Lee HJ. The future perspectives in transrectal prostate ultrasound guided biopsy. Prostate Int. 2014;2(4):153-160. doi:10.12954/PI.14062.
10. Salami SS, Ben-Levi E, Yaskiv O, et al. In patients with a previous negative prostate biopsy and a suspicious lesion on magnetic resonance imaging, is a 12-core biopsy still necessary in addition to a targeted biopsy? BJU Int. 2015;115(4):562-570. doi:10.1111/bju.12938.
11. Murphy G, Haider M, Ghai S, Sreeharsha B. The Expanding Role of MRI in Prostate Cancer. 2013;(December):1229-1238. doi:10.2214/AJR.12.10178.
12. Cerantola Y, Haberer E, Torres J, et al. Accuracy of cognitive MRI-targeted biopsy in hitting prostate cancer-positive regions of interest. World J Urol. 2015. doi:10.1007/s00345-015-1588-2.
13. Bonekamp D, Jacobs M a, El-Khouli R, Stoianovici D, Macura KJ. Advancements in MR imaging of the prostate: from diagnosis to interventions. Radiographics. 2011;31(3):677-703. doi:10.1148/rg.313105139.
14. American College of Radiology. MR Prostate Imaging Reporting and Data System version 2.0. Disponível em: http://www.acr.org/Quality-Safety/Resources/PIRADS/.
15. Choi YJ, Kim JK, Kim N, Kim KW, Choi EK, Cho K-S. Functional MR Imaging of Prostate Cancer. Radiographics. 2007;27(1):63-75. doi:10.1148/rg.271065078.
16. Renard-Penna R, Mozer P, Cornud F, et al. Prostate Imaging Reporting and Data System and Likert Scoring System: Multiparametric MR Imaging Validation Study to Screen Patients for Initial Biopsy. Radiology. 2015;275(2):458-468. doi:10.1148/radiol.14140184.
17. Yablon C, Banner M. Complications of Prostate Cancer Treatment: Spectrum of Imaging Findings1. …. 2004;24:181-194. doi:10.1148/rg.24si045502.
18. Rud E, Klotz D, Rennesund K, et al. Preoperative magnetic resonance imaging for detecting uni- and bilateral extraprostatic disease in patients with prostate cancer. World J Urol. 2014;33(7):1015-1021. doi:10.1007/s00345-014-1362-x.
19. Jie C, Rongbo L, Ping T. The value of diffusion-weighted imaging in the detection of prostate cancer: A meta-analysis. Eur Radiol. 2014;24(8):1929-1941. doi:10.1007/s00330-014-3201-2.
20. Kitajima K, Kaji Y, Fukabori Y. Prostate Cancer Detection With 3 T MRI : Comparison of Diffusion-Weighted Imaging and Dynamic Contrast-Enhanced MRI in Combination With T2-Weighted Imaging. 2010;631:625-631. doi:10.1002/jmri.22075.




