 As mutações de ativação de EGFR (receptor do fator de crescimento epitelial), predominantemente localizadas nos exons 18-21, são encontradas em média em aproximadamente 25% dos pacientes com CPCNP. Em mais um tópico da coluna ‘Drops de Genômica, o oncologista André Murad (foto) explica as mutações de inserção do exon 20 do gene EGFR e sua importância no câncer de pulmão de células não pequenas (CPCNP).
As mutações de ativação de EGFR (receptor do fator de crescimento epitelial), predominantemente localizadas nos exons 18-21, são encontradas em média em aproximadamente 25% dos pacientes com CPCNP. Em mais um tópico da coluna ‘Drops de Genômica, o oncologista André Murad (foto) explica as mutações de inserção do exon 20 do gene EGFR e sua importância no câncer de pulmão de células não pequenas (CPCNP).
Por André Marcio Murad*
As mutações de ativação de EGFR, predominantemente localizadas nos exons 18-21, são encontradas em média em aproximadamente 25% dos pacientes com CPCNP. As mais comuns, a substituição L858R no exon 21 e a deleção do exon 19 (ex19del), são sensíveis aos inibidores de tirosina quinase (TKIs) de EGFR, assim como mutações não canônicas (por exemplo, a G719X no exon 18 e a L861Q no exon 21).
No entanto, os TKIs anti-EGFR atualmente disponíveis em doses padrão não são eficazes contra a grande maioria das mutações de inserção do exon 20 do EGFR (ex20ins), uma família diversa de mutações que, até recentemente, eram conhecidas como "mutações de resistência" devido a esta insensibilidade aos TKIs anti-EGFR usualmente empregados.
Este paradigma começou recentemente a mudar com o desenvolvimento de novas terapias visando especificamente a essas mutações (por exemplo, o anticorpo biespecífico EGFR/MET amivantamabe, recentemente aprovado pela FDA para pacientes que progrediram à quimioterapia ou quimioimunoterapia no cenário de primeira linha).
As mutações EGFR ex20ins são condutores moleculares de CPCNP da mesma forma que as mutações EGFR comuns L858R e ex19del. Inicialmente, houve a impressão de que essas mutações eram incomuns, mas provavelmente porque não estavam sendo adequadamente procuradas. Em vez disso, os laboratórios estavam testando o L858R e o ex19del por causa da aprovação de medicamentos específicos para essas mutações. No entanto, por meio do sequenciamento cuidadoso e amplo do exon 20 do EGFR em pacientes com CPCNP avançado, descobriu-se que as mutações EGFR ex20ins respondem por até 12% de todas as mutações ativadoras do EGFR, tornando-as o terceiro tipo mais comum de mutação do EGFR após o ex19del (45%) e L858R (40%). Além disso, os casos com mutação de ex20ins EGFR compreendem aproximadamente 1% -2% do COCNP do tipo não escamoso.
Mutações de EGFR, incluindo EGFR ex20ins, são testadas por sequenciamento de DNA. Isso pode ser realizado com métodos baseados em reação em cadeia da polimerase (PCR) ou ensaios de sequenciamento de próxima geração (NGS) baseados em DNA, sendo atualmente a tecnologia preferida para uso, considerando sua natureza abrangente e o número crescente de biomarcadores direcionáveis que precisam ser testados como padrão de atendimento em pacientes com CPCNP avançado.
Há alguns pontos importantes ao se testar as mutações EGFR ex20ins por NGS. Em primeiro lugar, não se deve presumir que todos os ensaios de teste NGS cubram mutações de ex20inas de EGFR; os detalhes do ensaio devem ser sempre confirmados. Em segundo lugar, nem todas as mutações das ex20inas do EGFR são de sensibilidade. Esta é uma grande família de mutações complexas, das quais um pequeno número é sensível aos TKIs EGFR tradicionais.
Assim, é importante que os detalhes da mutação específica identificada por NGS sejam relatados, bem como sejam compreendidos por aqueles que recebem os relatórios, de modo que a terapia apropriada, seja um TKI de EGFR padrão ou um novo agente direcionado especificamente para mutações de ex20inas de EGFR, seja escolhido apropriadamente.
Embora a inclusão da pesquisa de EGFR ex20ins no rastreamento genômico inicial seja o ideal, a mesma pode ser realizada quando da progressão da doença à quimioterapia ou quimioimunoterapia no cenário de primeira linha, uma vez que o tratamento específico para esta variante é uma opção de segunda linha de tratamento.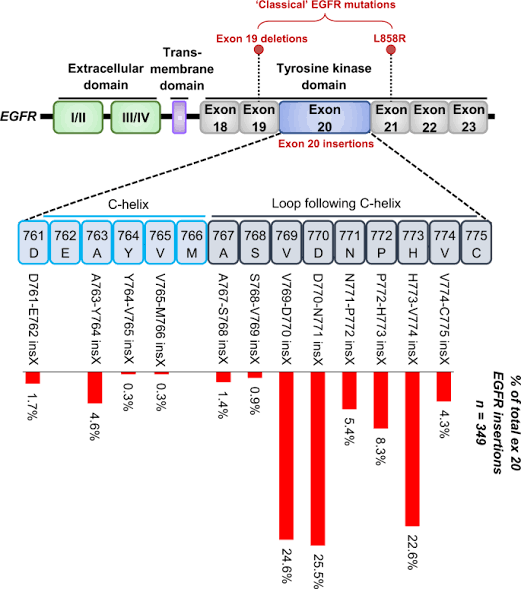
*André Murad é diretor científico do Grupo Brasileiro de Oncologia de Precisão (GBOP), diretor clínico da Personal - Oncologia de Precisão e Personalizada, professor adjunto coordenador da Disciplina de Oncologia da Faculdade de Medicina da UFMG, e oncologista e oncogeneticista da CETTRO Oncologia (DF)




