 A combinação de ibrutinibe e venetoclax demonstrou melhoria estatisticamente significativa na sobrevida livre de progressão em comparação com ibrutinibe + placebo em pacientes com linfoma de células do manto recidivante/refratário. Os resultados são de análise primária do estudo de Fase 3 SYMPATICO, selecionado como Late Breaking Abstract (LBA-2) no ASH 2023. Michael Wang (foto), professor na Universidade do Texas MD Anderson Cancer Center, é o primeiro autor do trabalho.
A combinação de ibrutinibe e venetoclax demonstrou melhoria estatisticamente significativa na sobrevida livre de progressão em comparação com ibrutinibe + placebo em pacientes com linfoma de células do manto recidivante/refratário. Os resultados são de análise primária do estudo de Fase 3 SYMPATICO, selecionado como Late Breaking Abstract (LBA-2) no ASH 2023. Michael Wang (foto), professor na Universidade do Texas MD Anderson Cancer Center, é o primeiro autor do trabalho.
O inibidor de tirosina quinase (BTK) de Bruton Ibrutinib (Ibr) uma vez ao dia é aprovado em muitos países para pacientes com linfoma de células do manto que receberam ≥1 terapia anterior. Venetoclax (Ven) é um inibidor de BCL-2 aprovado nos EUA para pacientes com leucemia linfocítica crônica e leucemia mieloide aguda não tratada anteriormente. Ibrutinibe e venetoclax têm modos de ação distintos e complementares, e a combinação mostrou atividade clínica promissora em estudos de fase inicial em linfoma de células do manto (Tam, N Engl J Med 2018; Wang, J Hematol Oncol 2021).
Agora, no ASH 2023, Wang e colegas apresentaram os resultados da análise primária do estudo multinacional, randomizado, duplo-cego, de Fase 3 SYMPATICO (NCT03112174) comparando ibrutinibe + venetoclax versus ibrutinibe + placebo em pacientes com linfoma de células do manto recidivante/refratário.
No SYMPATICO, pacientes com ≥18 anos de idade com linfoma de células do manto recidivante/refratário após 1–5 terapias anteriores foram randomizados (1:1) para receber ibrutinibe 560 mg oral uma vez ao dia simultaneamente com venetoclax oral (aumento padrão de 5 semanas até uma dose alvo de 400 mg uma vez ao dia) ou placebo por 2 anos, seguido de ibrutinibe como agente único até a progressão da doença (DP) ou toxicidade inaceitável.
A randomização foi estratificada com base no performance status ECOG, linhas de terapia anteriores e risco de síndrome de lise tumoral (SLT) com base na carga tumoral e clearance de Creatinina (CrCl). O endpoint primário foi a avaliação da sobrevida livre de progressão (SLP) pelo investigador (INV) utilizando os critérios de Lugano; os pacientes sem progressão de doença ou morte foram censurados na última avaliação sem progressão de doença (de acordo com as regras globais de censura).
Análises de sensibilidade adicionais incluíram avaliação de SLP pelo comitê de revisão independente (IRC) e censura de acordo com as regras da U.S. Food and Drug Administration (Tabela). Os principais endpoints secundários foram testados hierarquicamente na seguinte ordem: taxa de resposta completa (CR) por avaliação do investigador, tempo até o próximo tratamento (TTNT), sobrevida global (SG, análise interina) e taxa de resposta global (ORR) por avaliação do investigador.
Resultados
267 pacientes foram incluídos e randomizados para ibrutinibe + venetoclax (n=134) ou ibrutinibe + placebo (n=133). A mediana de idade foi de 68 anos; 96% dos pacientes tinham ECOG PS de 0–1, 17% tinham ≥3 linhas de terapia anteriores e 22% apresentavam risco aumentado de síndrome de lise tumoral (SLT).
No baseline, os pacientes nos braços ibrutinibe + venetoclax versus ibrutinibe + placebo tinham mediana de 69 vs 67 anos de idade, score do Índice Prognóstico Internacional MCL simplificado de alto risco 38% vs 31%, doença volumosa ≥5 cm 46% vs 40%, envolvimento de medula óssea 46% vs 41%, esplenomegalia 31% vs 25% e mutação TP53 30% vs 28%; outras características basais foram semelhantes entre os braços.
Com um tempo médio de estudo de 51,2 meses, a mediana de SLP pela avaliação do investigador foi significativamente mais longa com Ibr+Ven versus Ibr+Pbo (31,9 vs 22,1 meses), com um hazard ratio (HR) de 0,65 (95% CI, 0,47–0,88; log-rank estratificado P = 0,0052) (Figura).
As taxas de SLP aos 24 meses foram de 57% e 45% com Ibr+Ven e Ibr+Pbo, respectivamente. O benefício da SLP com a combinação ibrutinibe + venetoclax foi consistente em subgrupos pré-especificados, incluindo aqueles com variante blastoide ou linfoma de células do manto com mutação TP53. As análises de sensibilidade da SLP foram consistentes com a análise primária (Tabela).
Ibrutinibe + venetoclax melhorou significativamente as taxas de resposta completa (54% vs 32%) e tempo até o próximo tratamento (mediana não alcançada [NR] vs 35,4 meses); no acompanhamento mediano atual de 51,2 meses, a mediana de SG foi de 44,9 meses com ibrutinibe + venetoclax versus 38,6 meses com Ibr+Pbo (HR 0,85 [95% CI, 0,62–1,19]) (Tabela). A mediana de duração do tratamento foi de 22,2 meses para o braço Ibr+Ven e 17,7 meses para o braço Ibr+Pbo; no momento da análise, 30% dos pacientes no braço com venetoclax e 20% dos pacientes no braço placebo permaneciam com ibrutinibe de agente único.
Eventos adversos (EAs) de grau ≥3 ocorreram em 84% dos pacientes com Ibr+Ven versus 76% com Ibr+Pbo; os mais frequentes (ocorrendo em ≥5% dos pacientes) foram neutropenia (31% vs 11%), pneumonia (13% vs 11%), trombocitopenia (13% vs 8%), anemia (10% vs 3%), diarreia (8% vs 2%), leucopenia (7% vs 0%), LCM (7% vs 12%), fibrilação atrial (5% vs 5%), COVID-19 (5% vs 1%) e hipertensão ( 4% contra 9%). EAs graves ocorreram em 60% dos pacientes em cada braço.
Não ocorreu nenhuma síndrome de lise tumoral clínica; A SLT laboratorial ocorreu em 5% e 2% dos pacientes nos braços Ibr+Ven e Ibr+Pbo, respectivamente. As mortes por COVID-19 ocorreram em 10 pacientes em cada braço e não tiveram impacto significativo no hazard ratio de SLP ou SG.
Em síntese, a combinação de ibrutinibe + venetoclax demonstrou uma melhoria estatisticamente significativa na SLP em comparação com ibrutinibe + placebo em pacientes com linfoma de células do manto recidvante/refratário. “As taxas de resposta completa e tempo para o próximo tratamento também melhoraram significativamente com a combinação com venetoclax. A sobrevida global foi numericamente, mas não significativamente melhorado nesta análise intermediária”, observaram os autores.
“O perfil de segurança de ibrutinibe + venetoclax foi consistente com eventos adversos conhecidos para cada agente, sem novos sinais de segurança. No geral, estes resultados demonstram um perfil risco-benefício favorável para ibrutinibe + venetoclax nessa população de pacientes”, concluíram os autores.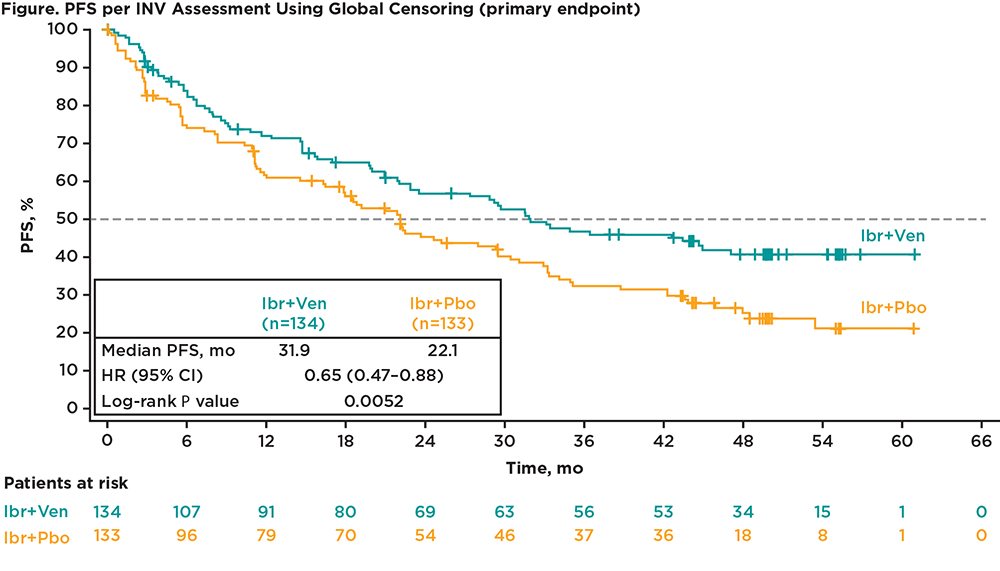
Primary and Secondary Efficacy Endpoints
lbr+Ven (n=134) | lbr+Pbo (n=133) | HR (or rate ratio) (95% CI)ª | P valueb | |
Median PFS by INV, mo | ||||
Global censoringc | 31.9 | 22.1 | 0.65 (0.47-0.88) | 0.0052 |
US FDA censoringd | 42.6 | 22.1 | 0.60 (0.44-0.83) | 0.0021 |
Median PFS by IRC, mo | ||||
Global censoringc | 31.8 | 20.9 | 0.67 (0.49-0.91) | 0.0108 |
US FDA censoringd | 43.5 | 22.1 | 0.63 (0.45-0.87) | 0.0057 |
Median TTNT, mo | NR | 35.4 | 0.60 (0.40-0.89) | 0.0096 |
ORR, % | 82 | 74 | 1.10 (0.97-1.25) | 0.1279 |
CR rate, % | 54 | 32 | 1.66 (1.24-2.22) | 0.0004 |
Median duration of response, mo | 42.1 | 27.6 | ||
Median duration of CR, mo | NR | 40.8 | ||
Median OS, mo (interim analysis) | 44.9 | 38.6 | 0.85 (0.62-1.19) | 03.465 |
aHRs are reported for PFS, TTNT, and OS; rate ratios are reported for CR and ORR.
B P values were determined by stratified log-rank test for PFS, TTNT, and OS, and by stratified Cochran-Mantel-Haenszel test for CR rate and ORR (stratifications factors: prior lines of therapy [1-2 vs ≥ 3] and TLS risk category [low vs increase risk].
cGlobal censorlng: pts without PD or death were censored at last follow-up without PFS event.
dUS FDA censoring: pts without PD or death, with subsequent anticancer therapy or with 2 or more missed prior to the PFS event were censored at last follow-up without PFS event.




