Terapia disponível para comercialização no Brasil desde agosto 2024.
A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou no Brasil o uso do radioligante vipivotida tetraxetana (177Lu), 177Lu-PSMA-617 para o tratamento do câncer de próstata metastático resistente a castração. 177Lu-PSMA-617 (Pluvicto®, Novartis) é indicado para pacientes com expressão de antígeno de membrana específico da próstata (PSMA) previamente tratados com inibição da via do receptor de andrógeno (AR) e quimioterapia baseada em taxano, reduzindo o risco de morte em 38% e o risco de progressão radiográfica ou morte em 60% na comparação com o padrão de cuidado. O oncologista Denis Jardim (foto), líder nacional de tumores urológicos da rede Oncoclínicas, analisa as evidências que embasaram essa aprovação.
A decisão da Anvisa foi publicada em 22 de dezembro de 2023 no Diário Oficial da União e é baseada nos resultados de eficácia e segurança do estudo de fase 3 VISION, ensaio que demonstrou benefício clínico e estatisticamente significativo de Pluvicto em todos os desfechos avaliados.
O PSMA assume importância crescente no câncer de próstata. “PSMA é uma glicoproteína transmembrana bastante utilizada como ferramenta diagnóstica. O ligante de PSMA marcado com radioemissores é muitas vezes utilizado para detectar metástases. No entanto, esse mesmo alvo pode ser utilizado como tratamento. Nesse caso, o ligante de PSMA é marcado com uma molécula emissora de radiação beta. O 177Lu-PSMA-617 é um radioligante e emite partículas beta que causam danos ao DNA e, consequentemente, a morte celular”, explica o oncologista.
Os resultados do estudo VISION foram publicados na New England Journal of Medicine (DOI: 10.1056/NEJMoa2107322) e evidenciam que a terapia com 177Lu- PSMA-617 prolongou a sobrevida livre de progressão radiográfica e a sobrevida global quando adicionada ao tratamento padrão em pacientes com câncer de próstata metastático resistente à castração com PSMA positivo.
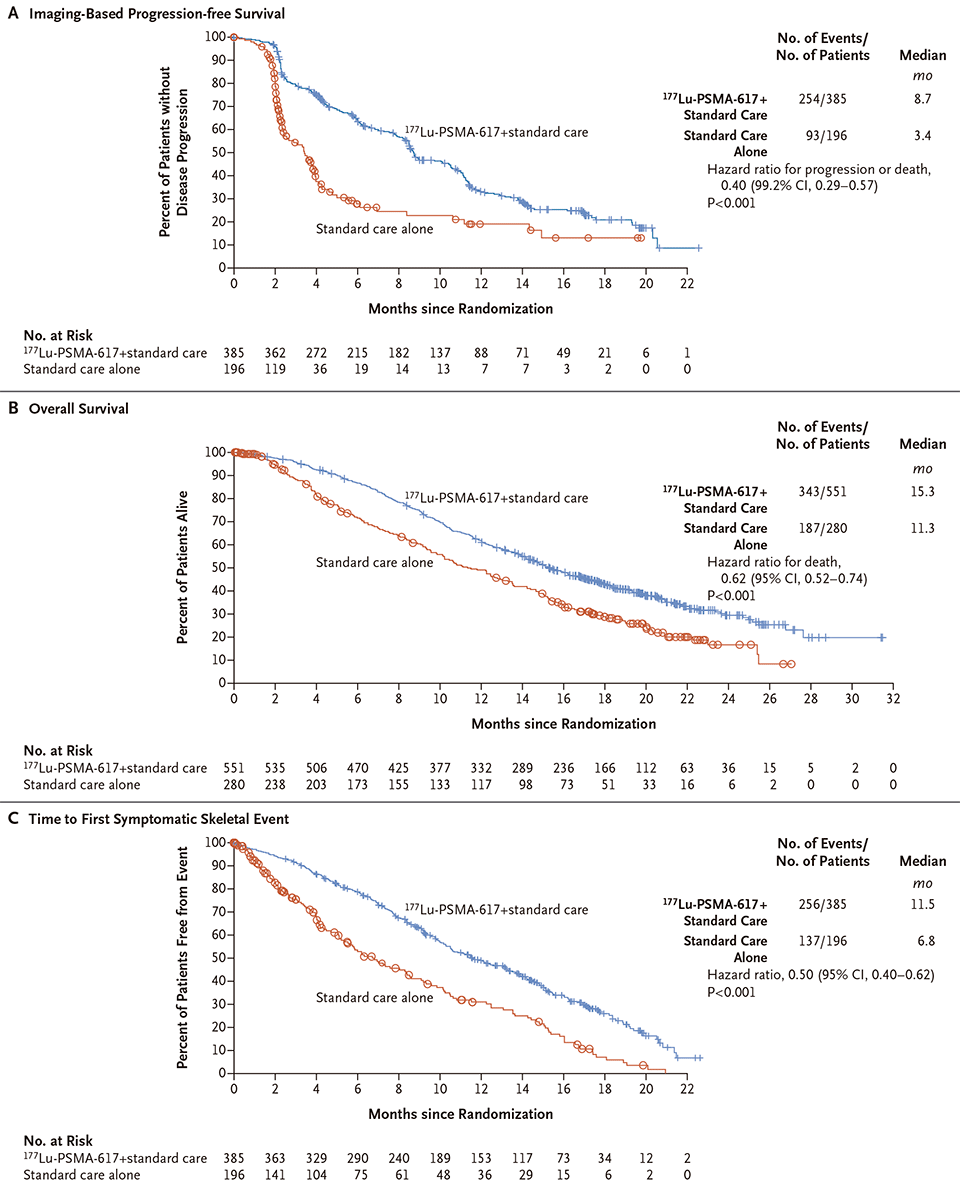
Neste estudo internacional, aberto, de fase 3 (NCT03511664), 831 pacientes foram randomizados em uma proporção de 2:1 para receber Lu-PSMA (7,4 GBq a cada 6 semanas durante quatro a seis ciclos) mais tratamento padrão ou apenas tratamento padrão. Os endpoints primários foram a sobrevida livre de progressão radiográfica e a sobrevida global. Entre os tratamentos padrões utilizados estavam os inibidores da via AR, medicamentos para dor, cetoconazol, terapia de radiação para alvos localizados; agentes direcionados aos ossos e corticosteroides. Endpoints secundários incluíram resposta objetiva, controle da doença e tempo até eventos esqueléticos sintomáticos.
Os pacientes elegíveis tinham metástase positiva para PSMA. O status de PSMA foi determinado com o uso de gálio-68 (68Ga) no PET-CT no início do estudo. A presença de lesões positivas para PSMA foi definida no protocolo como captação de 68Ga- PSMA maior que a do parênquima hepático em uma ou mais lesões metastáticas, de qualquer tamanho e localização anatômica.
Os dados relatados por Sartor et al. na NEJM revelam que, após seguimento mediano de 20,9 meses, o tratamento com Lu-PSMA prolongou significativamente a sobrevida livre de progressão baseada em imagens (mediana, 8,7 vs. 3,4 meses; razão de risco para progressão ou morte, 0,40; intervalo de confiança [IC] de 99,2%, 0,29 a 0,57; P<0,001) e a sobrevida global (mediana de 15,3 vs. 11,3 meses; razão de risco para morte, 0,62; IC 95%, 0,52 a 0,74; P<0,001), reduzindo em 38% o risco de morte.
O tempo médio até o primeiro evento esquelético sintomático ou morte foi de 11,5 meses no grupo 177Lu-PSMA-617, em comparação com 6,8 meses no grupo controle (razão de risco, 0,50; IC 95%, 0,40 a 0,62; P<0,001). Entre os 248 pacientes que apresentavam lesões-alvo mensuráveis no início do estudo (RECIST, versão 1.1), a resposta completa foi observada em 17 dos 184 pacientes (9,2%) no grupo 177Lu- PSMA-617 e em nenhum dos 64 pacientes no grupo controle. Um total de 77 pacientes (41,8%) tiveram resposta parcial no grupo 177Lu-PSMA-617 versus apenas 2 (3%) no grupo controle.
“É importante destacar que estamos falando de uma população bastante tratada. Um total de 41% dos pacientes incluídos no estudo VISION já tinham recebido dois taxanos e 49% já tinham falhado a abiraterona e a enzalutamida”, observa Denis Jardim. “Os dois desfechos de eficácia demonstraram a superioridade de Lu-PSMA, com benefício de sobrevida livre de progressão, reduzindo em 60% o risco de progressão, além do ganho de sobrevida global, com um hazard ratio de 0,62 para risco de morte, ambos com significância estatística”, acrescenta o oncologista.
Em relação ao perfil de segurança, a incidência de eventos adversos de grau 3 ou superior foi maior no grupo tratado com 177Lu-PSMA-617 (52,7% vs. 38,0%), mas a qualidade de vida não foi afetada negativamente. “O estudo VISION mostrou que 177Lu-PSMA-617 também proporcionou algumas métricas superiores de qualidade de vida, incluindo o tempo até a deterioração da qualidade de vida medido na escala FACT-T, e mais que dobrou o tempo até piora da dor, passando de 2,4 meses no braço controle para 9,7 meses de mediana no braço 177Lu-PSMA-617, um resultado bastante robusto”, descreve Jardim.
Dados do estudo de fase 2 TheraP (NCT03392428) em homens com câncer de próstata metastático resistente à castração mostram que 177Lu-PSMA-617 comparado com cabazitaxel levou a uma resposta mais alta do PSA (65 vs 37 respostas de PSA; 66% vs 37% por intenção de tratar; diferença de 29% (IC 95% 16–42; p<0,0001; e 66% vs 44% por tratamento recebido; diferença 23% [9–37]; p=0,0016). O radioligante 177Lu- PSMA-617 mostrou menos eventos adversos de grau 3 e 4 na comparação com cabazitaxel (33% versus 53%), projetando-se como um tratamento eficaz como potencial alternativa a cabazitaxel.
“O estudo TheraP traz, ainda, uma informação bastante relevante para a nossa prática clínica, que é a seleção de pacientes para 177-Lu, de acordo com a avaliação do exame de PET-PSMA. A depender da intensidade de captação, existe maior probabilidade de resposta com 177Lu-PSMA-617. Entre pacientes com média ≥ 10 SUVs (Standardized uptake values), 91% tiveram resposta de PSA. Naqueles com captação abaixo de 10 SUVs, 52% tiveram melhor resposta de PSA em relação a cabazitaxel”, compara o oncologista.
Assim, 177Lu-PSMA-617 (Pluvicto) mostra evidências de eficácia e segurança que embasaram a aprovação junto às principais agências reguladoras, como mostra resultados que colocam em perspectiva o uso do radioligante frente a terapias ativas, amparando sua indicação na prática clínica em pacientes com lesões captantes, após falha a um antiandrógeno e a pelo um taxano.
Aprovação de 177Lu-PSMA-617 pela ANVISA foi baseada no estudo VISION
O oncologista Denis Jardim, líder nacional de tumores urológicos da rede Oncoclínicas, fala sobre o radioligante 177Lu-PSMA-617 ou Vipivotida Tetraxetana (177Lu) no tratamento do câncer de próstata metastático resistente a castração. 177Lu-PSMA-617 (Pluvicto®, Novartis) é aprovado pela Anvisa com base nos resultados de eficácia e segurança do estudo de fase 3 VISION, indicado para pacientes com expressão de antígeno de membrana específico da próstata (PSMA) previamente tratados com inibição da via do receptor de andrógeno e quimioterapia baseada em taxano. O tratamento com Vipivotida Tetraxetana (177Lu) ou 177Lu-PSMA-617 ou reduziu o risco de morte em 38% e o risco de progressão radiográfica ou morte em 60% na comparação com o padrão de cuidado. O produto também foi aprovado pela CMED e está disponível para comercialização no país. Assista e saiba mais sobre esta inovadora terapia aprovada para comercialização desde agosto 2024.
- Sartor O, de Bono J, Chi KN, Fizazi K, Herrmann K, Rahbar K, Tagawa ST, Nordquist LT, Vaishampayan N, El-Haddad G, Park CH, Beer TM, Armour A, Pérez-Contreras WJ, DeSilvio M, Kpamegan E, Gericke G, Messmann RA, Morris MJ, Krause BJ; VISION Investigators. Lutetium-177-PSMA-617 for Metastatic Castration-Resistant Prostate N Engl J Med. 2021 Sep 16;385(12):1091-1103. doi: 10.1056/NEJMoa2107322. Epub 2021 Jun 23. PMID: 34161051; PMCID: PMC8446332.
- Hofman MS, Emmett L, Sandhu S, Iravani A, Joshua AM, Goh JC, Pattison DA, Tan TH, Kirkwood ID, Ng S, Francis RJ, Gedye C, Rutherford NK, Weickhardt A, Scott AM, Lee ST, Kwan EM, Azad AA, Ramdave S, Redfern AD, Macdonald W, Guminski A, Hsiao E, Chua W, Lin P, Zhang AY, McJannett MM, Stockler MR, Violet JA, Williams SG, Martin AJ, Davis ID; TheraP Trial Investigators and the Australian and New Zealand Urogenital and Prostate Cancer Trials Group. [177Lu] Lu-PSMA-617 versus cabazitaxel in patients with metastatic castration-resistant prostate cancer (TheraP): a randomised, open-label, phase 2 trial. 2021 Feb 27;397(10276):797-804. doi: 10.1016/S0140-6736(21)00237-3. Epub 2021 Feb 11. PMID: 33581798.
- Diário Oficial da União - Resolução-RE nº 884, de 21 de dezembro de 2023 - Publicado em: 22/12/2023 | Edição: 243 | Seção: 1 | Página: 19
Material destinado a profissionais habilitados a prescrever e/ou dispensar medicamentos. 2024© - Direitos Reservados - Novartis Biociências S/A. Proibida a reprodução total ou parcial sem a autorização do titular. Material produzido em Novembro/2024 – BR-31045
Para reportar um evento adverso entre em contato através do