Bottom Line
Múltiplas modalidades de tratamento, incluindo análogos de somatostatina, terapias-alvo, quimioterapia, radioisótopos e terapias locais têm papel assegurado no manejo de pacientes com TNE, mas questões como a melhor forma de avaliar resposta ao tratamento e de sequenciar as diferentes modalidades de terapia permanecem sem resposta.
Duílio Reis da Rocha Filho (foto) é chefe do Serviço de Oncologia Clínica do Hospital Universitário Walter Cantídio (UFC-CE), Oncologista Clínico da Clínica Fujiday, membro da Diretoria do Grupo Brasileiro de Tumores Gastrointestinais (GTG) e da Diretoria da Sociedade Brasileira de Oncologia Clínica (SBOC).
Duílio Reis da Rocha Filho1
1 Chefe do Serviço de Oncologia Clínica do Hospital Universitário Walter Cantídio (UFC-CE), Oncologista Clínico da Clínica Fujiday, membro da Diretoria do Grupo Brasileiro de Tumores Gastrointestinais (GTG) e da Diretoria da Sociedade Brasileira de Oncologia Clínica (SBOC)
Resumo
Os tumores neuroendócrinos (TNE) são uma condição de incidência crescente. Dentre os TNE, os tumores do trato digestivo são os mais comuns. Costumam ser neoplasias indolentes, embora o comportamento clínico seja heterogêneo e dependa de parâmetros como grau de diferenciação e sítio primário. Podem estar associados a sintomas secundários à produção hormonal, como na síndrome carcinoide. Uma cuidadosa avaliação com exames complementares é essencial no manejo de pacientes com TNE. Biomarcadores como a cromogranina e o ácido 5-hidroxiindolacético (5-HIAA) podem ter ampla aplicação clínica, mas apresentam sensibilidade e especificidade deficientes. Tomografias e ressonâncias são exames de imagem fundamentais no diagnóstico e no acompanhamento da doença, embora a avaliação de resposta de acordo com Response Evaluation Criteria in Solid Tumors (RECIST) tenha limitações em TNE. Exames funcionais, como imagens baseadas em receptores de somatostatina e FDG-PET-CT, têm papel definido em diferentes cenários clínicos e são úteis para a programação terapêutica. Múltiplas modalidades de tratamento, incluindo análogos de somatostatina, terapias-alvo, quimioterapia (QT), radioisótopos e terapias locais, têm papel assegurado no manejo da doença. Desde 2009, diversos estudos de fase III trouxeram novas perspectivas para os pacientes com TNE, mas questões como a melhor forma de avaliar resposta ao tratamento e de sequenciar as diferentes modalidades de terapia permanecem sem resposta definitiva.
Palavras-chave: Tumores neuroendócrinos; cintilografia de receptores de somatostatina; 68Ga-PET-CT; análogo da somatostatina; everolimo; sunitinibe; lutécio radioativo.
Introdução
Chamamos de TNE os tumores epiteliais com diferenciação predominantemente neuroendócrina, que podem surgir na maior parte dos órgãos do corpo. Quase dois terços dos tumores têm origem gastroenteropancreática. Entre 1973 e 2012, a incidência nos EUA saltou de 1,09 para 6,98 novos casos por 100.000 habitantes (DASARI, 2017).
Os TNE gastroenteropancreáticos (TNE-GEP) costumam ser pouco sintomáticos até fases avançadas da doença. Podem ser acompanhados de sintomas secundários à produção hormonal, como na síndrome carcinoide, caracterizada por crises de rubor facial, diarreia e, menos frequentemente, broncoespasmo, além de lesões valvares em câmaras cardíacas direitas. A síndrome carcinoide é identificada com maior frequência no TNE de origem em território jejunoileal, quase exclusivamente na presença de metástases hepáticas. Cerca de 30% dos TNE pancreáticos (TNE-P) acompanham-se de sintomas hormonais, mais comumente decorrentes da produção de insulina ou de gastrina (tabela 1).
Nome | Peptídeo | Localização | Malignidade (%) | Apresentação |
Insulinoma | Insulina | Pâncreas (>99%) | <10 | Hipoglicemia |
Gastrinoma | Gastrina | Duoodeno (70%), pâncreas (25%) | 60-90 | Dor, diarreia, dispepsia |
VIPoma | VIP | Pâncreas (90%) | 40-70 | Diarreia, hipocalemia |
Glucagonoma | Glucagon | Pâncreas (100%) | 50-80 | Rash, intolerância a glicose, perda de peso |
Somatostatinoma | Somatostatina | Pâncreas (55%), delgado (44%) | >70 | DM, colelitíase, diarreia |
Tabela 1. Principais síndromes relacionadas a tumores neuroendócrinos pancreáticos. DM, diabetes mellitus. Adaptado de Falconi et al, 2016.
Os TNE-GEP são indolentes na maior parte dos casos, embora o comportamento clínico seja heterogêneo e dependa de parâmetros como grau de diferenciação e sítio primário. A doença pouco diferenciada tem alto potencial metastático, sobrevida mediana curta e alta quimiossensibilidade. Os tumores bem diferenciados, por outro lado, têm crescimento lento, sobrevida mediana longa e costumam ser resistentes à quimioterapia. O sítio primário do TNE-GEP também tem importância prognóstica. Tumores de primário em delgado são mais indolentes, enquanto TNE de pâncreas e colorretais têm pior sobrevida (YAO, 2008).
Desenvolvimento
Diagnóstico e classificação
A taxa de proliferação celular, avaliada pelo índice Ki-67 ou pela contagem mitótica, exerce papel determinante na graduação de TNE (tabela 2) (LLOYD, 2017). Há controvérsias quanto ao ponto de corte ideal de Ki-67 para a categorização dos tumores. Uma análise de 252 pacientes escandinavos com TNE grau 3 mostrou que tumores com Ki-67 superiores a 55% apresentam maior quimiossensibilidade e pior prognóstico, o que sugere que uma subdivisão dos tumores grau 3 poderia ser informativa (SORBYE, 2013). De fato, em 2017 a Organização Mundial de Saúde propôs uma nova classificação que subdividiu os tumores neuroendócrinos pancreáticos grau 3 em duas categorias, a depender das características morfológicas de diferenciação (tabela 2) (LLOYD, 2017). Há a expectativa de que modificação semelhante seja implementada para os TNE gastrointestinais.
Grau | Diferenciação | Mitoses/10 CGA | Ki-67 (%) |
1 | Bem diferenciado | <2 | ≤2 |
2 | Bem diferenciado | 2-20 | 3-20 |
3 | Bem diferenciado* | >20 | >20 |
3 | Pouco diferenciado | >20 | >20 |
Tabela 2. Classificação dos tumores neuroendócrinos gastroenteropancreáticos segundo a Organização Mundial de Saúde. *O subtipo “bem diferenciado grau 3” se aplica exclusivamente aos tumores neuroendócrinos de pâncreas e tem Ki-67 mais comumente abaixo de 55%, enquanto os tumores pouco diferenciados costumam ter Ki-67 acima desse ponto de corte. Adaptado de Lloyd et al, 2017.
Exames complementares
Uma cuidadosa avaliação com exames complementares é parte fundamental do manejo do TNE. Há uma necessidade não atendida de biomarcadores tumorais que preencham os parâmetros aceitáveis de eficácia (sensibilidade superior a 80%, especificidade superior a 90% e valores preditivos positivo e negativos superiores a 80%) em TNE. Os biomarcadores atualmente disponíveis têm limitações importantes, e novos métodos que reflitam de forma acurada a atividade da doença e a eficácia do tratamento são necessários. Técnicas como assinaturas multigênicas, monitorização de células tumorais circulantes e avaliação de miRNA são promissoras e podem preencher a carência de marcadores de alto rendimento no universo do TNE (OBERG, 2015).
A cromogranina A (CgA), um produto do grânulo secretório neuroendócrino, é o biomarcador tumoral mais útil no manejo do TNE. Está elevada em 60 a 90% dos pacientes com TNE, independente do sítio primário. Correlaciona-se com o volume tumoral e com a sobrevida e é útil para fazer seguimento clínico e para avaliar a resposta à terapia dos pacientes. Entretanto, o método de avaliação de cromogranina carece de padronização, e os resultados podem variar de acordo com os anticorpos usados na análise. Diversas condições médicas podem estar associadas a elevações de CgA, como insuficiência renal, cardiopatia, tumores não-neuroendócrinos e o uso de inibidores de bombas de prótons (IBP), o que limita a especificidade a menos de 50% (OBERG, 2016). Devido a esses aspectos, o teste é uma recomendação de categoria 3 nas diretrizes do National Comprehensive Cancer Network (NCCN), o que denota grande discordância entre os especialistas (NCCN, 2018); por outro lado, é sugerido em cada visita de seguimento pela Sociedade Europeia de Tumores Neuroendócrinos (ENETS) (NIEDERLE, 2016). Não é um exame coberto pelas seguradoras de saúde no Brasil.
Em que pesem suas limitações, sugerimos considerar a pesquisa de cromogranina em intervalos de 3 a 12 meses, em conformidade com as diretrizes do ENETS e do Grupo Brasileiro de Tumores Gastrointestinais (GTG), especialmente na monitorização de doentes metastáticos (NIEDERLE, 2016; RIECHELMANN, 2017). Ressalte-se que elevações de cromogranina devem ser analisadas no contexto de uma avaliação global da doença, e não devem motivar, isoladamente, alterações de conduta (RIECHELMANN, 2017). Recomenda-se que, se possível, pacientes em uso de IBP interrompam a medicação por duas semanas ou substituam-na por um antagonista do receptor H2 antes de efetuar a dosagem de CgA.
O ácido 5-hidroxindolacético (5-HIAA) é um metabólito da serotonina que se correlaciona intimamente com a presença de síndrome carcinoide. Sua elevação sugere a presença de um tumor primário de intestino médio (jejunoileal, de apêndice ou do cólon proximal), uma vez que raramente está aumentado em TNE de outros sítios (OBERG, 2017). Sua importância é limitada pelas numerosas condições que interferem no resultado do exame. Tabagismo, consumo de café ou álcool, alimentos como banana, abacate, abacaxi, ameixa, kiwi, espinafre e tomate e medicamentos como paracetamol, diazepam, metildopa e fenobarbital devem ser evitados nas 48 horas que antecedem a coleta (OBERG, 2017). Idealmente, pacientes em tratamento com análogo da somatostatina devem fazer a coleta imediatamente antes da dose subsequente, de forma a evitar valores de 5-HIAA artificialmente baixos (RIECHELMANN, 2017). A dosagem de 5-HIAA deve ser considerada na abordagem inicial do paciente com TNE intestinal, especialmente se jejunoileal ou na presença de síndrome carcinoide, e nas consultas de seguimento (RIECHELMANN, 2017; NCCN, 2018).
Exames de imagem são fundamentais para localizar o tumor primário, identificar sítios de doença metastática, investigar a expressão de receptores de somatostatina e avaliar a resposta ao tratamento. Tomografias (TC) e ressonâncias (RNM) são os métodos anatômicos mais empregados, mas cuidados técnicos são essenciais para otimizar a sensibilidade dos exames. A RNM é ligeiramente superior à TC, principalmente na avaliação do fígado e do pâncreas. Metástases hepáticas de TNE podem ser de difícil identificação à TC, uma vez que são comumente isodensas em relação ao fígado nas imagens de fase venosa portal (figura 1). Por esse motivo, a realização de exame trifásico é recomendada (LEUNG, 2013). A avaliação de resposta por RECIST tem limitações em TNE, assim como em outras neoplasias em que agentes biológicos citostáticos são parte importante do tratamento. Apesar disso, os critérios RECIST seguem sendo utilizados nos maiores estudos clínicos de TNE. 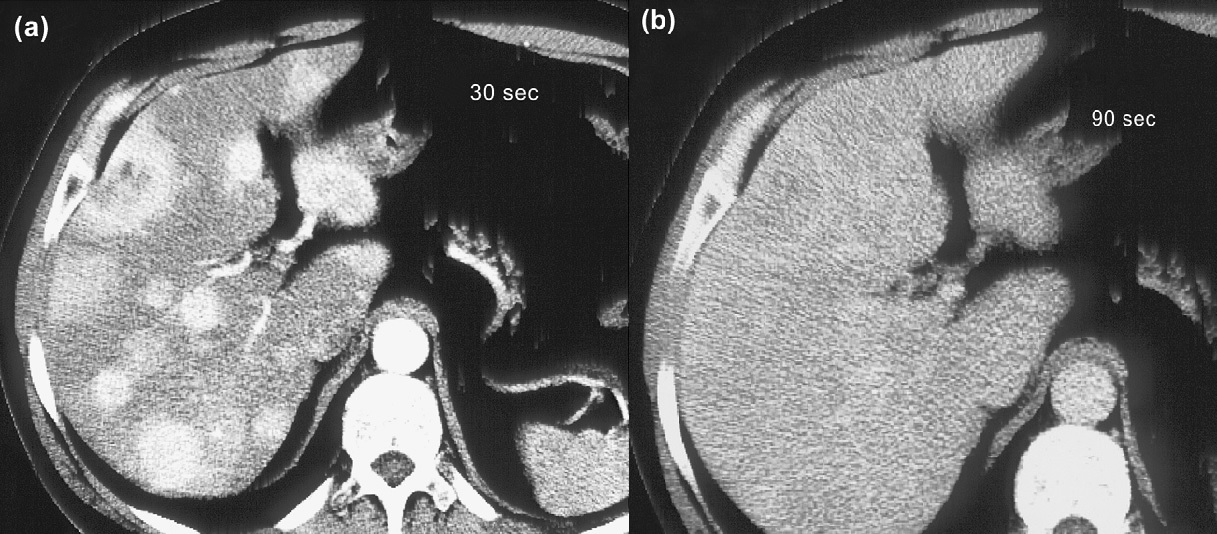 Figura 1: TC de abdome em paciente com tumor neuroendócrino com metástases hepáticas após 30 segundos (a) e 90 segundos (b) da injeção do meio de contraste. O realce das lesões desaparece na fase venosa. Adaptado de Rockall e Reznek, 2007.
Figura 1: TC de abdome em paciente com tumor neuroendócrino com metástases hepáticas após 30 segundos (a) e 90 segundos (b) da injeção do meio de contraste. O realce das lesões desaparece na fase venosa. Adaptado de Rockall e Reznek, 2007.
Receptores de somatostatina são detectados em cerca de 90% dos pacientes com TNE, e uma imagem baseada em receptores de somatostatina, como Octreoscan e 68Ga-DOTATOC-PET, deve ser considerada na avaliação inicial. Tem a vantagem de refinar o estadiamento sistêmico, ajudar na localização do tumor primário e avaliar a sensibilidade a estratégias voltadas para receptores de somatostatina (análogos e radioisótopos). O 68Ga-DOTATOC-PET tem melhor resolução anatômica e acurácia, o que é importante nos casos em que a localização precisa dos sítios de doença tem potencial de mudança de conduta.
FDG-PET-CT é um exame de baixa sensibilidade na avaliação do TNE bem diferenciado (figura 2), ao passo que a taxa de detecção é alta em pacientes com Ki-67 superior a 15%. Em um estudo prospectivo, a sobrevida mediana de pacientes com FDG-PET-CT negativo e positivo foi de 119,5 meses e 15 meses, respectivamente (P<0,001) (BAHRI, 2014). Um FDG-PET-CT positivo, assim, sugere menor diferenciação tumoral e exige que se considere a necessidade de intervenções terapêuticas mais rigorosas. 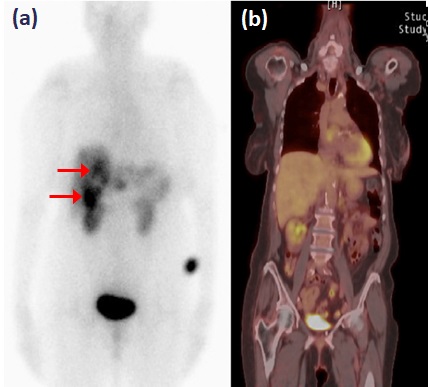 Figura 2: Exames funcionais de tumor neuroendócrino bem diferenciado metastático. Captação em fígado (setas) ao Octreoscan (a), mas não ao FDG-PET-CT (b). Adaptado de Leung et al, 2013.
Figura 2: Exames funcionais de tumor neuroendócrino bem diferenciado metastático. Captação em fígado (setas) ao Octreoscan (a), mas não ao FDG-PET-CT (b). Adaptado de Leung et al, 2013.
Tratamento
Todos os pacientes com TNE-GEP devem ser considerados candidatos potenciais à cirurgia. No manejo da doença não passível de ressecção curativa, a definição da estratégia terapêutica depende de múltiplos parâmetros, como a diferenciação tumoral, a agressividade da neoplasia, o volume da doença e a presença de sintomas hormonais e não hormonais, e envolve intervenções locais e sistêmicas.
Em doentes com TNE-GEP bem diferenciado avançado, há múltiplas opções de tratamento. Estratégias de controle local, sejam cirúrgicas, com técnicas ablativas ou com tratamentos intra-arteriais, devem ser consideradas nos pacientes com doença predominantemente hepática. A sobrevida em 5 anos de pacientes submetidos a ressecção de metástases hepáticas é de 70%, enquanto não supera 50% em controles históricos (SAXENA, 2012). Ao contrário do observado em câncer colorretal, as metastasectomias raramente são curativas em TNE, de forma que, em longo prazo, a grande maioria dos doentes têm recidiva da doença. Transplante hepático pode ser considerado em casos muito selecionados, desde que a doença seja exclusivamente hepática, bem diferenciada e, de preferência, após terem sido exauridas outras opções terapêuticas (PARTELLI, 2017).
Os análogos de somatostatina, octreotida e lanreotida, são frequentemente a estratégia inicial de tratamento sistêmico do TNE-GEP. Em pacientes com tumores funcionantes, controlam os sintomas hormonais em até 80% dos casos, além de prover resposta bioquímica em dois terços dos doentes (NIEDERLE, 2016).
Dois estudos de fase III, PROMID e CLARINET, documentaram o papel antiproliferativo dos análogos. No estudo PROMID, pacientes com tumores de intestino médio ou de sítio primário desconhecido, sem terapia prévia, foram tratados randomicamente com octreotida-LAR 30 mg a cada 28 dias ou placebo. O tempo para progressão mediano, desfecho primário do estudo, aumentou de 5,9 meses para 15,6 meses no grupo tratado com o análogo (HR 0,33; IC 95% 0,19-0,55; P<0,001) (RINKE, 2009).
O estudo CLARINET aleatorizou pacientes com TNE-GEP não-funcionante para tratamento com lanreotida 120 mg a cada 28 dias ou placebo. Identificou-se aumento de sobrevida livre de progressão (SLP) no grupo tratado (mediana 18 meses versus não atingida; HR 0,47; IC 95% 0,30-0,73; P<0,001) (CAPLIN, 2014). Após esses estudos, o emprego de análogos passou a ser recomendado no manejo inicial de GEP-NET avançado, funcionante ou não, em especial se Ki-67 abaixo de 10%.
Outra estratégia aceitável em pacientes com TNE indolente, assintomático e de pequeno volume é um período de observação inicial, seguido por início de tratamento quando da progressão da doença. Em pacientes com tumores funcionantes, o interferon oferece controle de sintomas equiparável ao obtido com análogos, embora a toxicidade da imunoterapia tenha limitado seu emprego de forma mais ampla.
O papel das terapias-alvo no manejo do TNE pancreático bem diferenciado avançado está bem estabelecido. O estudo de fase III RADIANT-3 tratou 410 pacientes com TNE-P em progressão nos 12 meses anteriores à randomização com everolimo 10 mg/dia ou placebo. Houve aumento da SLP mediana com o everolimo de 4,6 para 11 meses (HR 0,35; IC 95% 0,27-0,45; P<0,001) (YAO, 2011). Com desenho similar, um estudo com 171 pacientes mostrou que sunitinibe 37,5 mg/dia também aumenta a SLP quando comparado com placebo (mediana 5,5 versus 11,4 meses; HR 0,42; IC 95% 0,26-0,66; P<0,001). A taxa de resposta (TR) identificada foi inferior a 10% com ambos os agentes biológicos, mas cerca de dois terços dos pacientes tratados com everolimo ou sunitinibe tiveram alguma redução da massa tumoral com o uso do biológico (RAYMOND, 2011).
Os dois estudos fizeram das terapias-alvo opção sólida no manejo inicial de TNE-P, em especial quando se documenta um maior volume de doença, ou no tratamento de segunda linha. Não há dados que comparem a eficácia de everolimo com a do sunitinibe nesse cenário, e o diferente perfil de toxicidade das drogas deve ser considerado quando da seleção do tratamento.
O impacto das terapias-alvo no tratamento do TNE gastrointestinal foi inicialmente demonstrado apenas em tumores funcionantes. O estudo RADIANT-2 comparou everolimo 10 mg/dia com placebo em pacientes com TNE não pancreático em progressão, com sintomas secretores carcinoides. Ambos os braços também receberam octreotida-LAR para controle sintomático. Observou-se um aumento não significativo da SLP mediana de 11,3 para 16,4 meses (HR 0,77; IC 95% 0,59-1,00; P=0,026, acima do limiar pré-estabelecido de significância estatística) (PAVEL, 2011).
Análise estatística pré-especificada por IPCW, uma ferramenta que busca corrigir desequilíbrios das características basais e diferentes padrões de censura, sugeriu benefício do everolimo (HR 0,60, IC 95% 0,44-0,84; P=0,001). Diante dos dados desse estudo, o everolimo passou a ser considerado também no tratamento de TNE não pancreático funcionante em progressão, em especial em segunda linha ou posterior (PAVEL, 2012).
Em seguida, a publicação do estudo RADIANT-4 expandiu as indicações do everolimo aos tumores gastrointestinais não funcionantes. O estudo incluiu 302 pacientes com TNE não funcionante em progressão com sítio primário gastrointestinal ou pulmonar (YAO, 2016). Em randomização 2:1, os doentes foram submetidos a tratamento com everolimo 10 mg/dia ou placebo. A SLP mediana avaliada pela revisão radiológica central, desfecho primário do estudo, foi de 3,9 meses e 11,0 meses nos braços placebo e everolimo, respectivamente (HR 0,48; IC 95% 0,35-0,67; P<0,001) (figura 3). A taxa de controle de doença foi maior no braço experimental (65% versus 82%), ao passo que respostas objetivas foram raras em ambos os grupos (1% versus 2%).
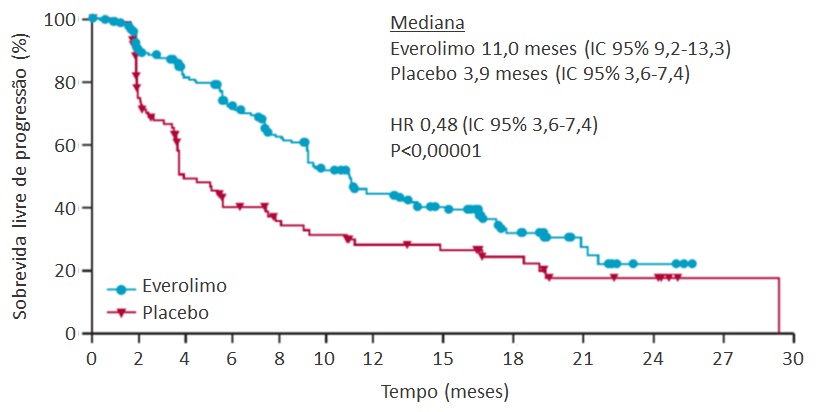 Figura 3: Sobrevida livre de progressão no estudo RADIANT-4. HR, hazard ratio. IC, intervalo de confiança. Adaptado de Yao et al, 2016.
Figura 3: Sobrevida livre de progressão no estudo RADIANT-4. HR, hazard ratio. IC, intervalo de confiança. Adaptado de Yao et al, 2016.Radioisótopos como o lutécio radioativo têm sido utilizados no manejo do TNE-GEP há mais de 20 anos. A maior parte dos estudos retrospectivos e de fase II reporta taxas de resposta de 15% a 35%, com dados de sobrevida livre de progressão que parecem se comparar favoravelmente com outras modalidades de tratamento. Fatores preditores de resposta ao lutécio são alta captação à imagem baseada em receptores de somatostatina, bom performance status e baixo volume tumoral hepático.
A carência de estudos randomizados avaliando o papel dos radioisótopos foi suprida pelo estudo NETTER-1, que incluiu 230 pacientes com TNE de intestino médio bem diferenciado com progressão após octreotida 20-30 mg e com receptores de somatostatina presentes em todas as lesões-alvo. Os doentes receberam tratamento com 177Lu-Dotatate (lutécio radioativo) por total de quatro aplicações, a cada 8 semanas, associado a octreotida-LAR 30 mg, ou aumento de dose da octreotida-LAR para 60 mg a cada 28 dias (STROSBERG, 2017). Houve aumento da sobrevida livre de progressão, desfecho primário do estudo, no grupo tratado com lutécio (mediana 5,9 meses versus 28,4 meses; HR 0,21; IC 95% 0,13-0,33; P<0,0001) (STROSBERG, 2018) (figura 4).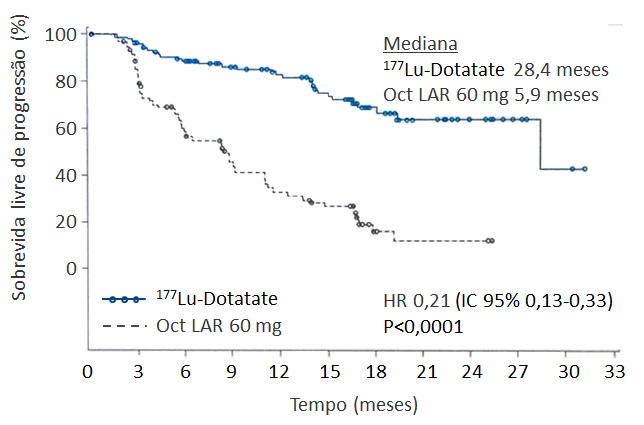 Figura 4: Sobrevida livre de progressão no estudo NETTER-1. Adaptado de Strosberg et al, 2018. HR, hazard ratio; Oct LAR, octreotida LAR.
Figura 4: Sobrevida livre de progressão no estudo NETTER-1. Adaptado de Strosberg et al, 2018. HR, hazard ratio; Oct LAR, octreotida LAR.
A taxa de resposta foi maior no grupo tratado com o radioisótopo (3% versus 19%; P<0,0004). A avaliação de sobrevida global é imatura, mas foram observados menos óbitos no grupo exposto a lutécio (43 versus 28 eventos), ainda que sem significância estatística. Eventos adversos sérios relacionados ao tratamento, normalmente secundários a toxicidade hematológica ou renal, foram descritos em 9% dos pacientes (STROSBERG, 2017; STROSBERG, 2018).
Os dados do NETTER-1 confirmam os resultados dos estudos anteriores e asseguram à terapia com radioisótopos papel no manejo do TNE com expressão de receptores de somatostatina. Em pacientes com TNE pancreático, o tratamento nuclear não foi avaliado em estudo randomizado. Contudo, a experiência do Erasmus Medical Center indica uma TR numericamente maior nesse grupo de doentes, quando comparados com pacientes com tumores carcinoides (42,8% versus 22,3%) (KWEKKEBOOM, 2008), o que sugere que a modalidade também deve ser considerada no manejo do TNE-P.
O melhor momento para indicar o tratamento com lutécio radioativo não está claro. Após progressão com análogo da somatostatina, tanto o uso de lutécio radioativo quanto o de everolimo ou sunitinibe (este no caso de TNE-P) são sustentados por estudos de fase III. Há algum receio quanto à toxicidade hematológica tardia em doentes expostos a radioisótopos, assim como a um eventual risco de pior tolerância a linhas subsequentes de tratamento, motivos pelos quais alguns especialistas têm preferido usar o lutécio mais tardiamente na evolução da doença (BERGSMA, 2015). Por outro lado, a toxicidade aguda do lutécio radioativo é menor que a do everolimo ou sunitinibe, e a comparação indireta dos dados de resposta e de SLP parece favorecer o tratamento com radioisótopos.
Seguindo as recomendações do ENETS e do GTG, temos recomendado o emprego de lutécio após falha à terapia medicamentosa, como terceira linha de tratamento (HICKS, 2017; RIECHELMANN, 2017). Em casos selecionados em que eventual progressão possa trazer maior risco de complicações, nossa prática tem sido favorecer uso de lutécio mais precocemente, logo após falha a análogo da somatostatina.
O papel da quimioterapia no tratamento do TNE-GEP bem diferenciado continua a ser debatido. As evidências consistem basicamente em pequenos estudos retrospectivos ou de fase II, que comumente avaliam populações heterogêneas. Em resumo, os dados apontam que o TNE pancreático é sensível à QT, com TR que varia de 30% a 70%, ao passo que a resposta do TNE gastrointestinal à QT é desprezível.
A melhor evidência acerca do papel de quimioterapia em TNE é o estudo randomizado de fase II E2211, apresentado na ASCO 2018. Um total de 144 pacientes com TNE-P bem diferenciado em progressão foi tratado com temozolomida (Tem) ou com a associação temozolomida + capecitabina (Tem + Cape). O braço da combinação teve maior SLP mediana (14,4 meses versus 22,7 meses; HR 0,58; IC 95% 0,36-0,93; P=0,023) (figura 5). A TR foi de 27,8% e 33,3% nos braços Tem e Tem + Cape, respectivamente (P=0,47) (KUNZ, 2018).
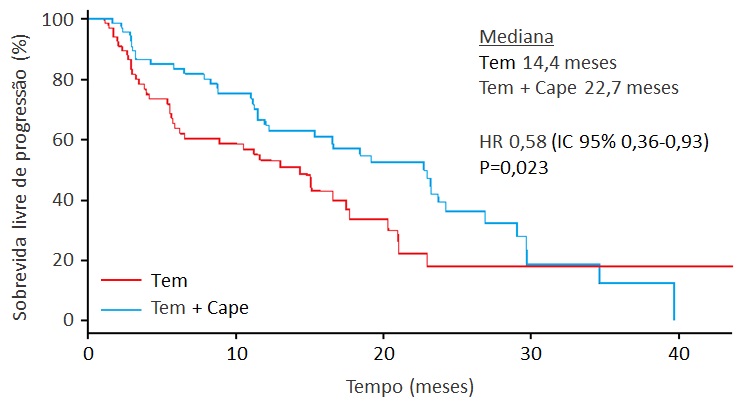 Figura 5: Sobrevida livre de progressão no estudo E2211. Cape, capecitabina; HR, hazard ratio; Tem, temozolomida.
Figura 5: Sobrevida livre de progressão no estudo E2211. Cape, capecitabina; HR, hazard ratio; Tem, temozolomida.
O estudo E2211 reforça a impressão de que QT é um tratamento ativo em TNE pancreático, associado a citorredução significativa e a SLP prolongada. Assim, QT deve ser considerada em pacientes para quem se busca maior resposta tumoral ou após falha a terapias-alvo, em especial nos casos com maior expressão de Ki-67. Além da associação Tem + Cape, regimes baseados em estreptozotocina (que não está disponível no Brasil), oxaliplatina ou dacarbazina podem ser empregados (STROSBERG, 2015; RIECHELMANN, 2017). Por outro lado, a indicação de QT em pacientes com TNE gastrointestinal é controversa, e deve ser limitada àqueles doentes que exauriram outras opções terapêuticas (PAVEL, 2012).
O inibidor de síntese de serotonina telotristat etil mostrou contribuir para o controle de diarreia em pacientes com síndrome carcinoide refratária. No estudo de fase III TELESTAR, as doses de 250 mg e 500 mg de telotristat etil, três vezes ao dia, foram comparadas com placebo em 135 pacientes. Resposta, definida como uma redução de pelo menos 30% da frequência de evacuações diarreicas em pelo menos metade do período do estudo, foi observada em 44% e 42% dos pacientes que receberam a dose de 250 mg e 500 mg, respectivamente (KULKE, 2017). Em pacientes com doença estabilizada aos exames de imagem, mas com um controle inadequada da diarreia, o uso de telotristat é mais uma opção terapêutica. A droga ainda não está disponível no Brasil. Uma sugestão de algoritmo de tratamento de TNE-GEP bem diferenciado está ilustrada na figura 6.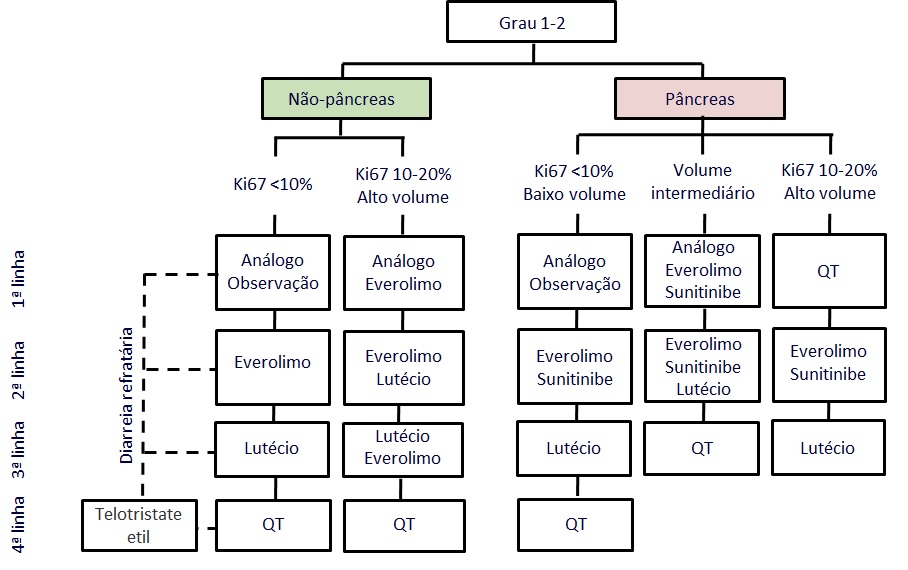
Figura 6: Proposta de algoritmo de manejo dos tumores neuroendócrinos gastroenteropancreáticos localmente avançados ou metastáticos, não passíveis de terapias locais.
Doentes com TNE-GEP grau 3 formam um grupo heterogêneo. Estudo retrospectivo mostrou que a resposta à QT em doentes com TNE grau 3 e Ki-67 inferior a 55% é de apenas 15%, enquanto o grupo com maior proliferação celular tem TR de 42% (P<0,001) (SORBYE, 2013). Tumores avançados com morfologia pouco diferenciada e Ki67 mais elevado costumam ser tratados exclusivamente com quimioterapia citotóxica. Recomendam-se regimes baseados em cisplatina, à semelhança dos utilizados no tratamento do câncer de pequenas células de pulmão. A doença é sensível à QT, com TR que chega a 60%. Por outro lado, a resposta ao tratamento costuma ser fugaz, e a sobrevida mediana desse grupo de doentes é de apenas 6 a 12 meses (YAO, 2008; SORBYE, 2013). Já em tumores graus 3, mas com morfologia bem diferenciada e Ki-67 mais baixo, o tratamento deve ser individualizado. Opções dirigidas para tumores bem diferenciados, como biológicos e radioisótopos, e quimioterapia baseada em oxaliplatina, temozolomida, irinotecano ou cisplatina podem ser considerados nesse grupo (CORIAT, 2016; SKOVGAARD, 2018).
Conclusão
TNE são tumores considerados raros, mas sua incidência tem aumentado ao longo das últimas décadas. A padronização universal da graduação tumoral e da classificação permitiu facilitar a comparação dos resultados de estudos clínicos e o manejo de pacientes com a doença. Exames de imagem morfológica e funcional têm refinado o diagnóstico, estadiamento e avaliação de resposta ao tratamento, mas nenhuma modalidade de imagem isoladamente pode prover todas as informações necessárias. Apesar de sua ampla aplicabilidade, os biomarcadores atualmente utilizados, como a CgA e o 5-HIAA, têm sensibilidade ou especificidade deficiente, e melhores biomarcadores são necessários. Uma combinação racional dos métodos de imagem disponíveis, baseada nos pontos fortes e nas limitações de cada técnica, ajuda a otimizar a avaliação dos pacientes com TNE. Novas ferramentas diagnósticas e terapêuticas têm emergido nos últimos anos e levado a uma melhoria lenta, mas constante, nos desfechos clínicos dos pacientes. Apesar dos avanços, questões como a melhor forma de avaliar resposta ao tratamento e o melhor sequenciamento das diferentes modalidades de terapia permanecem em aberto.
Referências:
Bahri H, Laurence L, Edeline J et al. High prognostic value of 18F-FDG PET for metastatic gastroenteropancreatic neuroendocrine tumors: a long-term evaluation. J Nucl Med. 2014; 55(11):1786-90
Bergsma H, Konijnenberg MW, Kam BL et al. Subacute haematotoxicity after PRRT with 177Lu-DOTA-octreotate: prognostic factors, incidence and course. Eur J Nucl Med Mol Imaging 2016; 43(3):453-63.
Caplin ME, Pavel M, Ćwikła JB et al. Lanreotide in metastatic enteropancreatic neuroendocrine tumors. N Engl J Med 2014;371(3):224-33.
Coriat R, Walter T, Terris B et al. Gastroenteropancreatic Well-Differentiated Grade 3 Neuroendocrine Tumors: Review and Position Statement. Oncologist 2016; 21(10):1191-1199.
Dasari A, Shen C, Halperin D et al. Trends in the Incidence, Prevalence, and Survival Outcomes in Patients With Neuroendocrine Tumors in the United States. JAMA Oncol 2017; 3(10):1335-1342.
Falconi M, Eriksson B, Kaltsas G et al. ENETS Consensus Guidelines Update for the Management of Patients with Functional Pancreatic Neuroendocrine Tumors and Non-Functional Pancreatic Neuroendocrine Tumors. Neuroendocrinology 2016; 103(2):153-71.
Hicks RJ, Kwekkeboom DJ, Krenning E et al. ENETS Consensus Guidelines for the Standards of Care in Neuroendocrine Neoplasia: Peptide Receptor Radionuclide Therapy with Radiolabeled Somatostatin Analogues. Neuroendocrinology 2017; 105(3):295-309.
Kunz PL, Catalano PJ, Nimeiri H et al. A randomized study of temozolomide or temozolomide and capecitabine in patients with advanced pancreatic neuroendocrine tumors: A trial of the ECOG-ACRIN Cancer Research Group (E2211). J Clin Oncol 2018; 36 (15 suppl): 4004-4004.
Kwekkeboom DJ, de Herder WW, Kam BL et al. Treatment with the radiolabeled somatostatin analog [177 Lu-DOTA 0,Tyr3]octreotate: toxicity, efficacy, and survival. J Clin Oncol 2008; 26(13):2124-30.
Leung D, Schwartz L. Imaging of neuroendocrine tumors. Semin Oncol 2013; 40(1):109-19.
Lloyd RY, Kloppel G, Rosai J et al. WHO classification of tumours of endocrine origin. IARC, Lyon, 2017.
National Comprehensive Cancer Network (NCCN). NCCN Clinical Practice Guidelines in Oncology. Neuroendocrine and Adrenal Tumors, Version 2.2018. Disponível em www.nccn.org/professionals/physician_gls/pdf/neuroendocrine.pdf
Niederle B, Pape UF, Costa F et al. ENETS Consensus Guidelines Update for Neuroendocrine Neoplasms of the Jejunum and Ileum. Neuroendocrinology 2016; 103(2):125-38.
Oberg K, Modlin IM, De Herder W et al. Consensus on biomarkers for neuroendocrine tumour disease. Lancet Oncol 2015 ;16(9):e435-46.
Oberg K, Couvelard A, Delle Fave G et al. ENETS Consensus Guidelines for Standard of Care in Neuroendocrine Tumours: Biochemical Markers. Neuroendocrinology 2017; 105(3):201-211.
Partelli S, Bartsch DK, Capdevila J et al. ENETS Consensus Guidelines for Standard of Care in Neuroendocrine Tumours: Surgery for Small Intestinal and Pancreatic Neuroendocrine Tumours. Neuroendocrinology 2017; 105(3):255-265.
Pavel ME, Hainsworth JD, Baudin E et al. Everolimus plus octreotide long-acting repeatable for the treatment of advanced neuroendocrine tumours associated with carcinoid syndrome (RADIANT-2): a randomised, placebo-controlled, phase 3 study. Lancet 2011; 378(9808):2005-12.
Raymond E, Dahan L, Raoul JL et al. Sunitinib malate for the treatment of pancreatic neuroendocrine tumors. N Engl J Med 2011; 364:501-513
Riechelmann RP, Weschenfelder RF, Costa FP et al. Guidelines for the management of neuroendocrine tumours by the Brazilian gastrointestinal tumour group. Ecancermedicalscience 2017; 11:716.
Rinke A, Müller HH, Schade-Brittinger C et al. Placebo-controlled, double-blind, prospective, randomized study on the effect of octreotide LAR in the control of tumor growth in patients with metastatic neuroendocrine midgut tumors: a report from the PROMID Study Group. J Clin Oncol 2009; 27:4656-63.
Rockall AG, Reznek RH. Imaging of neuroendocrine tumours (CT/MR/US). Best Pract Res Clin Endocrinol Metab 2007; 21 (1):43-68.
Saxena A, Chua TC, Perera M et al. Surgical resection of hepatic metastases from neuroendocrine neoplasms: a systematic review. Surg Oncol 2012;21(3):e131-41.
Skovgaard D, Fazio N, Granberg D et al. Peptide Receptor Radionuclide Therapy (PRRT) in Gastroenteropancreatic Grade 3 Neuroendocrine Neoplasms: A Retrospective International Multicenter Study. 15th Annual ENETS conference 2018, abst 2072
Sorbye H, Welin S, Langer SW et al. Predictive and prognostic factors for treatment and survival in 305 patients with advanced gastrointestinal neuroendocrine carcinoma (WHO G3): the NORDIC NEC study. Ann Oncol 2013;24(1):152-60.
Strosberg J, Goldman J, Costa F et al. The Role of Chemotherapy in Well-Differentiated Gastroenteropancreatic Neuroendocrine Tumors. Front Horm Res 2015; 44:239-47.
Strosberg J, El-Haddad G, Wolin E. Phase 3 Trial of 177Lu-Dotatate for Midgut Neuroendocrine Tumors. N Engl J Med 2017; 376(2):125-135.
Strosberg J, Wolin E, Chasen B et al. Overall Survival, Progression-Free Survival, and Quality of Life Updates from the NETTER-1 Study: 177Lu-Dotatate vs. High Dose Octreotide in Progressive Midgut Neuroendocrine Tumors. 15th Annual ENETS conference 2018, abst 2038
Yao JC, Hassan M, Phan A et al. One hundred years after "carcinoid": epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United States. J Clin Oncol 2008; 26:3063-3072.
Yao JC, Shah MH, Ito T et al. Everolimus for advanced pancreatic neuroendocrine tumors. N Engl J Med 2011; 364:514-523.
Yao JC, Fazio N, Singh S et al. Everolimus for the treatment of advanced, non-functional neuroendocrine tumours of the lung or gastrointestinal tract (RADIANT-4): a randomised, placebo-controlled, phase 3 study. Lancet 2016; 387(10022):968-977.
[sexypolling id="10"]




