Bottom Line
O linfoma de Hodgkin é uma doença linfoproliferativa de origem B, dividida em dois grupos (Linfoma de Hodgkin clássico e Linfoma de Hodgkin predomínio linfocitário nodular) e relacionada ao vírus Epstein-Barr. O LH geralmente se apresenta com linfonodomegalia de crescimento lento e progressivo. Febre, sudorese noturna e perda de peso, denominados sintomas B, podem estar presentes. O diagnóstico do LH é feito através de biópsia excisional do linfonodo ou área acometida. O estadiamento é fundamental para o planejamento terapêutico, tanto na doença localizada quanto no cenário avançado. O LH é bastante sensível à quimioterapia e radioterapia, projetando-se como a neoplasia linfóide mais curável em jovens e adultos.

Otávio Baiocchi é Professor Adjunto e Chefe do Departamento de Oncologia clínica e experimental da Universidade Federal de São Paulo - UNIFESP, Membro do comitê cientifico do Registro Brasileiro de Linfoma de Hodgkin, Coordenador do Núcleo Educativo Assistencial em Oncologia (NEA-Onco), Coordenador do ambulatório de linfomas da UNIFESP e médico da equipe de hematologia do Grupo Américas.
Por Otávio Baiocch1 e Adriana M. Damasco Penna2
Professor Adjunto e Chefe do Departamento de Oncologia clínica e experimental da Universidade Federal de São Paulo - UNIFESP, Membro do comitê cientifico do Registro Brasileiro de Linfoma de Hodgkin, Coordenador do Núcleo Educativo Assistencial em Oncologia (NEA-Onco), Coordenador do ambulatório de linfomas da UNIFESP e médico da equipe de hematologia do Grupo Américas.
Doutora em hematologia pela Universidade Federal de São Paulo - UNIFESP. Médica da equipe de hematologia do Hospital Santa Catarina e da Casa de Saúde Santa Marcelina. Responsável pelo Ambulatório de Linfomas do Hospital do Servidor Público Municipal de São Paulo – HSPM.
Resumo
Este artigo de revisão discute as recomendações para diagnóstico, estadiamento e tratamento do LH. Trata-se de neoplasia linfoide descrita em 1832 por Thomas Hodgkin e definida histologicamente pelos patologistas Carl Sternberg e Dorothy Reed no começo do século 20. Na década de 80, o vírus Epstein-Barr foi identificado como importante agente etiológico no LH.
Com curso indolente, o LH geralmente se apresenta com aumento ganglionar cervical e mediastinal de crescimento lento e indolor, com sintomas B (febre ≥ 37,8oC, sudorese noturna intensa, perda ponderal > 10% do peso corporal basal durante os seis meses que antecedem o diagnóstico). Também é frequente a presença de prurido cutâneo generalizado. A distribuição etária é bimodal, com grande pico na terceira década de vida e outro após os 50 anos.
O diagnóstico é feito por meio de biópsia excisional de linfonodo aumentado ou de área extranodal acometida. A punção aspirativa por agulha fina (PAAF) pode ser sugestiva de LH, mas não é suficiente para subclassificar a doença. A reação de imuno-histoquímica é altamente recomendada para confirmação diagnóstica.
O estadiamento é fundamental para o planejamento terapêutico e deve considerar história clínica e exame físico, biópsia bilateral de medula óssea para definir infiltração pelo linfoma, exames laboratoriais, incluindo dosagem de VHS e DHL, usados como marcadores de atividade de doença, além de exames de imagens (tomografia de tórax, abdome e pelve com contraste ou, quando disponível, PET-CT.
O tipo e intensidade do tratamento dependem do estadiamento. Na doença inicial, as opções são os esquemas ABVD, Stanford V e BEACOPP. Na doença refratária à terapia inicial, os esquemas mais utilizados são ICE, IGEV, DHAP e GDP.
O transplante de células-tronco hemotopoéticas alogênico é outra opção. Recentemente, o uso de sangue de cordão umbilical e o transplante alogênico haplo-idêntico têm merecido atenção, com resultados promissores. O uso de anticorpos, como o anti CD-20 rituximabe e o anti-CD30 brentuximabe vedotin ampliaram as taxas de resposta nos casos de recidiva pós transplante autólogo ou em paciente que falharam à terapia de primeira linha e são inelegíveis ao transplante autólogo.
Palavras-chave: ‘Linfoma de Hodgkin’, diagnóstico, estadiamento, tratamento, ‘neoplasias linfoproliferativas’
Introdução
O linfoma de Hodgkin é uma neoplasia linfóide de origem linfocitária B descrita inicialmente em 1832 por Thomas Hodgkin, e definida histologicamente pelos patologistas Carl Sternberg e Dorothy Reed no começo do século 20. Segundo a Organização Mundial da Saúde (OMS), o linfoma de Hodgkin pode ser classificado em duas entidades (Quadro 1):
Quadro 1. Classificação do linfoma de Hodgkin.
| Linfoma de Hodgkin predomínio linfocítico nodular |
| Linfoma de Hodgkin clássico (subtipos): |
| 1- Esclerose nodular |
| 2- Celularidade mista |
| 3- Rico em linfócitos |
| 4- Deplação linfocitária |
Fonte: Organização Mundial da Saúde (OMS), 2001.
O linfoma de Hodgkin clássico (LHc) compreende 4 subtipos: Esclerose nodular, celularidade mista, rico em linfócitos e depleção linfocítária e abrange um total de 95% dos casos diagnosticados de LH. O diagnóstico do LHc baseia-se no achado das células de Reed-Sternberg (RS), já o diagnóstico do LHPLN caracteriza-se pela presença de células linfóides grandes com membrana irregular chamadas de células de Hodgkin (em inglês também chamadas popcorn cells ou células em pipoca).
A incidência do LHc tem se mantido estável nas últimas décadas. Segundo dados do Instituto Nacional do Câncer (INCA), estima-se que, no ano de 2018, 2530 casos novos de LHc serão diagnosticados no Brasil. A incidência é mais alta em homens e maior em caucasianos. A distribuição etária do linfoma de Hodgkin clássico é bimodal, com grande pico na terceira década de vida e um outro pico após os 50 anos. O subtipo esclerose nodular é o mais comum, representando cerca de 65% de todos os casos de linfoma de Hodgkin clássico. O subtipo celularidade mista representa 25% dos casos. Os demais subtipos juntos representam cerca de 10% dos casos de LHc. Até o momento, não existem muitos dados epidemiológicos disponíveis para o Linfoma de Hodgkin com Predomínio Linfocitário Nodular (LHPLN), provavelmente por ser uma entidade recentemente reconhecida pela classificação da OMS em 2001. A incidência do LHPLN parece ser maior no sexo masculino e mais comum na terceira e quarta décadas de vida.
Na década de 80, através da utilização dos métodos de hibridização in situ e imuno-histoquímica, proteínas do vírus Epstein-Barr (EBV) foram identificadas nas células RS. Este achado, somado a evidências sorológicas e epidemiológicas, colocou o EBV como importante agente etiológico no surgimento do linfoma de Hodgkin clássico.
O EBV pode ser detectado nas células de RS em uma porcentagem variável dos casos de LHc, dependendo de fatores socioeconômicos e geográficos. No Brasil, o grupo de estudos de linfoma de Hodgkin da UNIFESP mostrou uma taxa de prevalência do EBV nas células de RS de 85% em pacientes da Região Norte e de 44% em pacientes da cidade de São Paulo. O achado do EBV nas células de RS é mais comum em crianças e pré-adolescentes (< 15 anos) e em idosos (> 65 anos) e parece não guardar relação com o prognóstico destes pacientes.
Em imunossuprimidos infectados pelo vírus da imunodeficiência adquirida (HIV) e na população pós-transplante, a incidência do LH EBV-relacionado é alta, podendo chegar a 90%. Pacientes imunossuprimidos de uma maneira geral possuem risco relativo de 6 a 8 vezes maior de desenvolverem LHc quando comparados com a população normal, corroborando mais uma vez a ideia da imunossupressão como um ambiente propício para a proliferação desenfreada do EBV (4-5). Quando infecta as células RS, o EBV expressa três proteínas de membrana na superfície destas células: EBNA-1 (Epstein-Barr nuclear antigen 1), LMP-1 (latent membrane protein 1) e LMP-2 (latent membrane protein 2). Estas proteínas são importantes para o diagnóstico do LH EBV relacionado e para potenciais alvos terapêuticos.
QUADRO CLÍNICO
O linfoma de Hodgkin clássico e o linfoma de Hodgkin predomínio linfocitário nodular possuem apresentação indolente. Geralmente, o paciente se queixa de um linfonodomegalia de crescimento lento e progressivo, e em dois terços dos casos têm apresentação cervical e intratorácica. Adenopatia mediastinal é bastante comum no linfoma de Hodgkin clássico, principalmente nas mulheres com o subtipo esclerose nodular. Caracteristicamente, os linfonodos não são dolorosos à palpação e apresentam consistência fibroelástica. O linfoma de Hodgkin raramente se apresenta com comprometimento extra-nodal, diferentemente dos linfomas não-Hodgkin, onde o acometimento de órgãos extra-nodais, tais como pele, ossos e trato gastrointestinal, é relativamente comum. Quando o acometimento extra-nodal acontece, o pulmão e o fígado são os dois órgãos mais comumente afetados pelo linfoma de Hodgkin, principalmente em idosos. O comprometimento da medula óssea ocorre em 5 a 20% dos pacientes jovens, e é mais comum em pacientes idosos e em estadio avançado, e naqueles com sinais e sintomas constitucionais.
Sinais e sintomas constitucionais, denominados sintomas B, podem acompanhar o diagnóstico do linfoma de Hodgkin e influenciam o prognóstico. Os sintomas B são:
· Febre≥37,8oC
· Sudoresenoturna intensa
· Perda ponderal (> 10% do peso corporal basal durante os seis meses que antecedem o diagnóstico).
Em geral, a febre afeta cerca de um terço dos pacientes e se caracteriza por ser baixa e irregular. Raramente um padrão cíclico de febre alta por uma a duas semanas alternada com períodos afebris de duração semelhante; este fenômeno, quando presente, é patognomônico do linfoma de Hodgkin e recebe o nome de febre de Pel-Ebstein.
Uma outra queixa comum dos pacientes com linfoma de Hodgkin é o prurido generalizado inexplicado. Dor nos linfonodos imediatamente após o consumo de álcool também é um sinal peculiar e típico do linfoma de Hodgkin, porém raramente visto na prática clínica. A causa do prurido e da dor nos linfonodos após ingestão alcoólica ainda permanece obscura, mas parece estar relacionada às citocinas presentes e aumentadas no microambiente tumoral e no sangue periférico de pacientes com linfoma de Hodgkin.
Os achados laboratoriais do linfoma de Hodgkin são inespecíficos. O hemograma completo pode evidenciar leucocitose com predomínio de neutrófilos e eosinófilos ou leucopenia com linfocitopenia absoluta. Ambos os achados conferem pior prognóstico. Citopenias são consequência do envolvimento medular pelo linfoma ou, menos frequentemente, podem sugerir hiperesplenismo ou causa auto-imune. Um outro achado laboratorial comumente encontrado é a elevação da velocidade de hemossedimentação (VHS), estando relacionada à doença mais avançada e aos sinais e sintomas constitucionais.
ATENÇÃO – O linfoma de Hodgkin geralmente se apresenta com aumento ganglionar cervical e mediastinal de crescimento lento e indolor. Febre, sudorese noturna, perda de peso e prurido são sintomas comuns nos pacientes com linfoma de Hodgkin.
DIAGNÓSTICO
O linfoma de Hodgkin é uma neoplasia maligna composta principalmente por células inflamatórias (neutrófilos, eosinófilos, células NK além de linfócitos T e B), sendo que as células de RS e as células de Hodgkin perfazem apenas 1 a 5% de toda a massa tumoral.
O diagnóstico de linfoma de Hodgkin é feito por meio de biópsia excisional de linfonodo aumentado ou de área extranodal acometida. A punção aspirativa por agulha fina (PAAF) pode ser sugestiva de LH, mas não é suficiente para subclassificar a doença. A reação de imunohistoquímica é altamente recomendada para confirmação diagnóstica. As células de RS do LHc expressam CD15 e CD30, e apresentam negatividade para CD3, CD20 e CD45. No LHPLN as células de Hodgkin geralmente são CD45 e CD20 positivas, não expressam CD15 e raramente são positivas para o CD30. Confirmado o diagnóstico de LH, o próximo passo é proceder com o estadiamento do paciente.
O estadiamento é fundamental para o planejamento terapêutico do linfoma de Hodgkin (quadro 2) e tem como objetivo definir o número de sítios comprometidos, se há linfonodos envolvidos em um os dois lados do diafragma, se há grandes massas tumorais, também conhecidas como bulky, se há comprometimento extranodal e se há sintomas B. Para tanto, são necessários os seguintes procedimentos:
· História clínica e exame físico;
· Biópsia bilateral de medula óssea para definir infiltração pelo linfoma (que poderá ser desnecessária naqueles pacientes estadiados com PET_CT);
· Exames laboratoriais: hemograma completo, função hepática e renal, albumina, VHS e DHL (desidrogenase láctica), estes dois últimos usados como marcadores de atividade de doença;
· Tomografia de tórax, abdome e pelve com contraste ou, quando disponível, o exame de PET-SCAN (escaneamento por emissão de pósitrons) ou PET-TC (associado à tomografia computadorizada)
Cabe ressaltar que, concomitante aos exames de estadiamento, outros exames são fundamentais na avaliação inicial dos pacientes com LH, tais como: Teste de gravidez (sempre deve ser realizado em mulheres em idade fértil). Tanto homens quanto mulheres em idade reprodutiva devem passar por uma avaliação com uma equipe multidisciplinar de fertilidade e reprodução humana; Prova de função pulmonar e Ecocardiograma transtorácico, além de sorologias para hepatite B, C e HIV.
Após completo o estadiamento (Tabela 1), os pacientes com LHc são divididos em dois grupos:
· Linfoma de Hodgkin estadio localizado: estadio I ou II
· Linfoma de Hodgkin avançado: estadio III ou IV
Para os pacientes com LHc localizado, os principais fatores de mau prognóstico são (Quadro 3):
· Sintomas B
· Grande massa ganglionar ou massa bulky.Uma massa ganglionar é considerada bulky quando o diâmetro do seu maior eixo exceder 10cm (independente do seu local de acometimento), ou esta massa ocupar mais de 1/3 da cavidade torácica vista pela radiografia de tórax póstero-anterior (massa bulky mediastinal)
· Aumento de VHS(>30 para pacientes com sintomas B e >50 para pacientes sem sintomas B)
Para os pacientes com doença avançada sete fatores de mau prognóstico determinam o chamado IPS (International Prognostic Score) (Quadro 4). Para cada fator presente, uma redução de 7% a 8% na sobrevida global por ano é observada. São eles:
· Idade ≥ 45 anos
· Sexo masculino
· Estadio IV
· Albumina sérica < 4 g/dL
· Hemoglobina < 10,5 g/dL
· Leucocitose( > 15.000/mm3 leucócitos totais)
· Linfocitopenia(linfócitos < 8% do total de leucócitos e/ou contagem absoluta < 600/mm3).
ATENÇÃO: O estadiamento é fundamental para o planejamento terapêutico do linfoma de Hodgkin. Feito o estadiamento, os pacientes com linfoma de Hodgkin podem ser divididos em 02 grupos: Pacientes com doença localizada (estadio I e II); e pacientes com doença avançada (estadio III e IV).
Quadro 2. Estadiamento segundo Cotswolds
| Estadiamento | |
| I | Envolvimento de uma região linfonodal única ou estrutura linfóide (baço, timo, anel de Waldeyer) |
| II | Envolvimento ≥ 2 regiões linfonodais no mesmo lado do diafragma; número de sítios extra-nodais deve ser indicado por um sufixo;ex II3 |
| III | Envolvimento de regiões linfonodais de estruturas em ambos os lados do diafragma. |
| III1 | Com ou sem linfonodos portais, celíacos e hilar esplênico. |
| III2 | Com nódulos mesentéricos, ilíacos e para aórticos |
| IV | Envolvimento de sítios extra-nodais além dos designados em E Anotações: A = sem sintomas B B = com sintomas B (febre, sudorese noturna, perda de peso) X = doença “Bulky”= mediastino > 1/3 ou massa tumoral > 10cm E = Envolvimento extranodal único ou contíguo ou proximal à região nodal |
Além do estadiamento, os pacientes devem ser classificados de acordo com os fatores prognósticos descritos nos quadros 3 e 4. Estes fatores quantificam o risco de recidiva atribuído ao paciente.
Quadro 3. Fatores prognósticos em doença localizada (estádio I e II)
| Idade superior a 50 anos |
| VHS maior do que 50mm em pacientes assintomáticos |
| VHS maior do que 30mm em pacientes com sintomas B |
| Grande massa mediastinal |
| Doença localizada com mais de três regiões linfonodais acometidas |
Quadro 4. Fatores prognósticos em doença avançada (estádio III e IV)
| Albumina sérica <4g/dl |
| Hemoglobina < 10,5g/dl |
| Sexo Masculino |
| Idade > 45 anos |
| Leucócitos > 15.000/mm3 |
| Linfócitos < 600/mm3 ou < 8% |
TRATAMENTO
O linfoma de Hodgkin é a doença linfoproliferativa com maior chance de cura em jovens e adultos, podendo ser curável em cerca de 80% dos casos. Trata-se de uma neoplasia bastante sensível à quimioterapia e à radioterapia e o tipo e intensidade do tratamento depende, basicamente, do estadiamento obtido ao diagnóstico da doença. Assim, o tratamento do linfoma de Hodgkin clássico é direcionado para: pacientes com doença localizada e pacientes com doença avançada. Os esquemas atualmente utilizados para o tratamento do LHc são:
· ABVD (Adriamicina, Bleomicina, Vimblastina e Dacarbazina)
· Stanford V (Adriamicina, Vimblastina, Mechloretamina, Etoposide, Vincristina, Bleomicina e Prednisona)
· BEACOPP (Bleomicina, Etoposide, Adriamicina, Ciclofosfamida, Vincristina, Procarbazina e Prednisona)
É importante ressaltar que estes esquemas acima são igualmente eficazes. Os esquemas Stanford V e BEACOPP são mais mielotóxicos só devendo ser utilizados em situações especiais e de acordo com a experiência de cada instituição especializada no tratamento de pacientes com linfoma de Hodgkin. O esquema ABVD ainda é o esquema menos tóxico e mais utilizado no tratamento do LHc.
O tratamento radioterápico consiste na aplicação de 2400 a 3600 cGy em cada campo envolvido em doses fracionadas de 120 a 180 cGy. O efeitos colaterais e complicações da radioterapia dependem do volume irradiado, dose irradiada, técnica empregada, tipo de quimioterapia prévia e idade do paciente. Resumidamente, o tratamento para o linfoma de Hodgkin clássico compreende:
· Estadio IA e IIA (sem doença bulky): Quimioterapia com 4 ciclos de ABVD associada à Radioterapia de consolidação (2400 a 3000cGy)
· Estadio IB e IIB (sem doença bulky): Quimioterapia com 4 a 6 ciclos de ABVD associada à Radioterapia de consolidação (2400 a 3000cGy)
· Estadio I e II A ou B (com massa bulky): Quimioterapia com 6 ciclos de ABVD associada à Radioterapia de consolidação com (3000 a 3600 cGy).
· Estadio III e IVA ou B: Quimioterapia com 6 ciclos de ABVD ou BEACOPP associada ou não à Radioterapia. A Radioterapia está indicada nos casos de massa bulky.
Atualmente, o exame de PET-TC realizado após o segundo ciclo de ABVD (do inglês chamado de interin PET) tem grande importância prognóstica com impacto na sobrevida livre de doença de pacientes com LHc.
Quando o tratamento de primeira linha falha e o paciente apresenta linfoma de Hodgkin recidivado ou doença refratária à quimioterapia mieloablativa (quimioterapia de salvamento) com resgate de células tronco periféricas autólogas (transplante autólogo) tem sido a terapia de escolha nesta situação. Existem inúmeros esquema de salvamento que podem ser utilizados nesta situação, e a escolha deste esquema fica a critério da experiência do médico e da Instituição. Abaixo, estão listados alguns esquemas quimioterápicos de salvamento mais utilizados na prática clínica:
· ICE (Ifosfamida, Carboplatina e Etoposide)
· IGEV (Ifosfamida, Gemcitabina e Vinorelbine)
· DHAP (Dexametasona, Citarabina e Cisplatina)
· GDP (Gemcitabina, Dexametasona e Cisplatina)
O transplante de células tronco hemotopoéticas alogênico (aparentado e não aparentado) também é uma opção, porém os resultados obtidos até o momento mostram alta taxa de morbi-mortalidade. Recentemente a utilização do transplante alogênico haplo-idêntico (quando existe compatibilidade parcial entre doador e receptor) têm merecido atenção especial, com resultados promissores.
Em 2011, a agência reguladora dos Estados Unidos (Food and Drug Administration, FDA) liberou a utilização de um anticorpo monoclonal quimérico (anti-CD30 – Brentuximabe vedotin) nos casos de recidiva pós transplante autólogo ou em paciente que falharam a terapia de primeira linha e são inelegíveis para o transplante autólogo. O uso do Brentuximabe vedotin neste grupo de pacientes tem demonstrado resultados e a utlização desta droga ao esquema de primeira linha (ABVD) está sendo avaliada em estudos clínicos. Esta medicação já está liberada para comercialização no Brasil desde 2015. Outro avanço recente no tratamento do linfoma de Hodgkin clássico é o uso dos inibidores de PD-1 nivolumabe e pembrolizumabe. Estes medicamentos, já com aprovação para uso no Brasil, têm se mostrado eficazes no tratamento de 2ª e 3ª linhas.
O tratamento do linfoma de Hodgkin predomínio linfocitário nodular possui algumas peculiaridades que merecem atenção especial. Trata-se de uma neoplasia com taxas de cura muitas vezes superiores a 90%, porém com alta incidência de recidiva tardia.
As células de Hodgkin presentes neste tumor expressam o antígeno CD20, e, por conseguinte, podemos utilizar o anticorpo quimérico monoclonal anti-CD20 (Rituximabe) no tratamento deste linfoma. Diferente do linfoma de Hodgkin clássico, a radioterapia isolada (campo-envolvido) é muitas vezes indicada nos pacientes com doença localizada. Abaixo estão os esquemas de quimioterapia mais utilizados no LHPLN
· ABVD (Adriamicina, Bleomicina, Vimblastina e Dacarbazina) + Rituximabe
· CHOP (Ciclofosfamida, Adriamicina, Vincristina e Prednisona) + Rituximabe
· EPOCH (Ciclofosfamida, Adriamicina, Etoposide, Vincristina e Prednisona) + Rituximabe
· Rituximabe isolado
É importante ressaltar que estes esquemas acima são igualmente eficazes. O tratamento do LHPLN está condicionado ao estadio do paciente e à presença de sintomas B. Resumidamente, o tratamento do LHPLN compreende:
1) Estadio IA e IIA: Radioterapia campo envolvido isolada (3000 a 3600 cGy). O uso de imunoterapia com Rituximabe associado à quimioterapia convencional deve ser utilizado nos casos de recidivas.
2) Estadio IB e IIB: Embora extremamente rara na doença localizada, a presença de sintomas B exige a terapia combinada com quimioterapia associada ao Rituximabe e radioterapia de consolidação (3000 a 3400 cGy)
3) Estadio III e IVcom ou sem sintomas B: Quimioterapia convencional associada ao Rituximabe. A radioterapia está indicada apenas nos casos de massa bulky.
COMPLICAÇÕES DO TRATAMENTO
O tratamento do linfoma de Hodgkin está associado a vários efeitos colaterais agudos e crônicos. O tratamento das complicações agudas da quimioterapia e da irradiação é relativamente fácil, sobretudo com o advento da terapia anti-emética altamente efetiva. O mais preocupante são os efeitos do tratamento tardio incluindo outros processos malignos e cardiopulmonares.
Leucemias e linfomas não-Hodgkin foram observados cerca de 10 a 20 anos após o tratamento bem-sucedido do linfoma de Hodgkin, principalmente com esquemas de poliquimioterapia mais antigos que utilizavam dentre outros medicamentos a mostarda nitrogenada (Mechloretamina). Em um estudo realizado na Disciplina de Hematologia e Hemoterapia da Universidade Federal de São Paulo (Souza et al), o risco de neoplasia secundária está associado ao uso prévio de mostarda, como no esquema MOPP/ABV (Mechloretamina, Vincristina, Procarbazina, Prednisona. Adriamicina, Bleomicina e Vimblastina). O risco de leucemia aguda é significativamente menor após o uso difundido do esquema ABVD. Outros tipos de neoplasias, como a neoplasia de mama e pulmão, estão associados à radioterapia, assim como o carcinoma basocelular e espinocelular de pele. Hipotireoidismo também é uma complicação frequente em pacientes que receberam radioterapia em região cervical.
Organograma de Tratamento de primeira linha para o LHc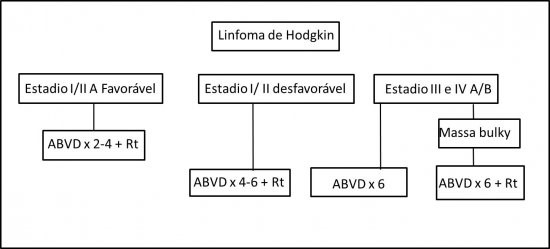
REVISÃO
O linfoma de Hodgkin é uma doença linfoproliferativa de origem B
O linfoma de Hodgkin pode ser dividido em dois grupos: 1- Linfoma de Hodgkin clássico e 2- Linfoma de Hodgkin predomínio linfocitário nodular
· O linfoma de Hodgkin está relacionado ao vírus Epstein-Barr
· Geralmente se apresenta com linfonodomegalia de crescimento lento e progressivo
· Febre, sudorese noturna e perda de peso, denominados sintomas B, podem estar presentes ao diagnóstico
· O diagnóstico do linfoma de Hodgkin é feito através de biópsia excisional do linfonodo ou área acometida
· O estadiamento é fundamental para o planejamento terapêutico do linfoma de Hodgkin
· O linfoma de Hodgkin é a neoplasia linfóide mais curável nos jovens e adultos
· O linfoma de Hodgkin é bastante sensível à quimioterapia e radioterapia
Referências Bibliográficas
1. Canellos GP, et al. Chemotherapy of Advanced Hodgkin’s Disease with MOPP, ABVD, or MOPP Alternating with ABVD. NEJM 1992;327:1478-84
2. Cerci JJ, et al. 18FDG PET after 2 cycles of ABVD predicts event-free survival in early and advanced Hodgkin lymphoma. J Nucl Med. 2010; 51 (9): 1337-1343.
3. Diehl V, et al. Standard and increased-dose BEACOPP chemotherapy compared with COPP-ABVD for advanced Hodgkin’s disease.N Engl J Med 2003 Jun 2;348(24):2386-95.
4. Diehl V, Thomas RK, Re D. Part II: Hodgkin’s lymphoma – diagnosis and treatment. Lancet Oncol. 2004; 5:19-26.
5. El-Galaly TC, et al. Positron emission tomography/computed tomography surveillance in patients with Hodgkin lymphoma in first remission has a low positive predictive value and high costs. Haematologica.2012 Jun;97(6):931-6.
6. Hasenclever D, Diehl V. A prognostic score for advanced Hodgkin’s disease. International Prognostic Factors Project on advanced Hodgkin’s Disease. N Engl J Med. 1998;339:1506-1514.
7. Lister TA, Crowther D, Sutcliffe SB, Glatstein E, Canellos GP, Young RC, et al. Report of a committee convened to discuss the evaluation and staging of patients with Hodgkin’s disease: Cotswolds meeting. J Clin Oncol. 1989; 7: 1630-1636
8. Patel V, et al. Computed tomography and positron emission tomography/computed tomography surveillance after combined modality treatment of supradiaphragmatic Hodgkin lymphoma: a clinical and economic perspective. Leuk Lymphoma. 2013 Oct;54(10):2168-76
9. Sarina B, et al. Allogeneic transplantation improves the overall and progression-free survival of Hodgkin lymphoma patients relapsing after autologous transplantation: a retrospective study based on the time of HLA typing and donor availability. Blood. 2010;115:3671-77.
Stein H. Hodgkin lymphoma. In: Swerdlow EH, Campo E, Harris NL, Jaffe ES, Pileri SA, Stein H,Thiele J, Vardimam JW (eds). World Health Organization Classification of Tumours of Haematopoietic and Lymphoid Tissues. IARC Press: Lyon. 2008:321-334.
Younes A, et al. Brentuximab vedotin (SGN-35) for relapsed CD30-positive lymphomas. N Engl J Med. 2010 Nov 4;363(19):1812-21.
Souza EM, Baiocchi OC, Zanichelli MA, et al. Impact of Epstein-Barr virus in the clinical evolution of patients with classical Hodgkin's lymphoma in Brazil. HematolOncol.2010;28(3):137.




