O câncer de esôfago é a oitava neoplasia mais incidente no mundo e a sexta causa de óbito por câncer. Um de seus tipos histológicos, o adenocarcinoma, tem registrado aumento progressivo de incidência, especialmente em países desenvolvidos. Em artigo exclusivo, especialistas do Departamento de Cirurgia Abdominal do A.C. Camargo Cancer Center revisam dados da literatura e as atualização no tratamento do adenocarcinoma de esôfago e de transição gastroesofágica. Os autores discorrem sobre a epidemiologia e fatores de risco, diagnóstico e estadiamento, além de traçar um panorama dos progressos terapêuticos e principais avanços cirúrgicos.
Epidemiologia e fatores de risco
 O câncer de esôfago é a oitava neoplasia mais incidente no mundo e a sexta causa de óbito por câncer1. Um dos seus tipos histológicos, o adenocarcinoma, tema desta discussão, tem registrado aumento progressivo de sua incidência, especialmente em países desenvolvidos2,3.
O câncer de esôfago é a oitava neoplasia mais incidente no mundo e a sexta causa de óbito por câncer1. Um dos seus tipos histológicos, o adenocarcinoma, tema desta discussão, tem registrado aumento progressivo de sua incidência, especialmente em países desenvolvidos2,3.
Parcela cada vez maior da população mundial é exposta aos fatores de risco para o adenocarcinoma de esôfago, como Doença do Refluxo Gastroesofágico (DRGE) sintomática, obesidade, Esôfago de Barrett, tabagismo e uma dieta pobre em frutas e vegetais4. Quanto à DRGE, a sua relação com a neoplasia é bem estabelecida, porém até 40% desses pacientes podem ser assintomáticos. Provavelmente, há uma superposição de fatores entre este diagnóstico e a obesidade, com um aumento do risco com essa associação5.
O Esôfago de Barrett representa um diagnóstico clínico e anatomopatológico. É necessária a caracterização de epitélio cor de “salmão” em localização cefálica em relação à junção esôfago-gástrica e o achado de epitélio colunar tipo intestinal substituindo o epitélio estratificado pavimentoso esofágico, em exame anatomopatológico. Essas alterações estão relacionadas ao desenvolvimento do adenocarcinoma, com risco estimado de cerca de 0,5% ao ano6. Este risco está aumentado quando há achado associado de displasia de alto grau, cuja progressão para adenocarcinoma ocorre em cerca de 40% dos casos7.
Diagnóstico e Classificação
O adenocarcinoma de esôfago se apresenta tardiamente, na maioria dos casos. Isso ocorre pelo atraso no diagnóstico e pela propensão da neoplasia em se disseminar mesmo em fases mais iniciais8. Os pacientes normalmente relatam sintomas de DRGE e evolução recente com disfagia, muitas vezes não relacionada a perda significativa de peso.
As ferramentas de estadiamento incluem TC de tórax, abdome, pelve e, em alguns casos, cervical, broncoscopia, ecoendoscopia e PET-CT. Em nossa rotina, empregamos tomografias de tórax, abdome e pelve para todos os casos. A imagem cervical é obtida em lesões torácicas altas e cervicais. Indicamos a broncoscopia em lesões torácicas altas e médias, para investigação de provável invasão da árvore brônquica. A ecoendoscopia fica reservada para situações em que não se identifica espessamento da parede esofágica nas tomografias realizadas9. O PET tem sido costumeiramente empregado nos casos de tumores localmente avançados, especialmente os elegíveis para tratamento multimodal. Este exame parece modificar a conduta terapêutica em até 25% dos pacientes demonstrando metástases à distância insuspeitas nos demais exames, bem como clarificando as rotas de disseminação linfonodal em alguns casos.
A classificação anatômica de Siewert, embora difícil de ser aplicada em determinadas situações, especialmente no cenário pré-operatório, é ainda a mais utilizada. Os tumores Siewert I são considerados os verdadeiros tumores do esôfago distal e os tipos II (cárdia) e III (fundo gástrico) são tratados mais frequentemente com uma gastrectomia total e esofagectomia distal.
Tratamento multimodal
O prognóstico de um paciente com adenocarcinoma esofágico depende essencialmente do estadiamento da neoplasia ao diagnóstico2. As casuísticas de tratamento cirúrgico exclusivo estão associadas a taxas de sobrevida global que não ultrapassam 35% em 5 anos, com recidiva predominantemente à distância, porém também com altas taxas de recidiva locorregional10. Pacientes com lesões localmente avançadas, definidas como aquelas em que a extensão do tumor primário vai além da camada muscular – T2, ou em que há comprometimento linfonodal regional, são candidatos às modalidades de tratamento multimodal11.
Existem diversos estudos randomizados que investigaram a associação de quimioterapia peri-operatória (neoadjuvante e adjuvante) intercalada com o tratamento cirúrgico; outros descrevendo a associação de quimioterapia e radioterapia neoadjuvantes seguidos de cirurgia; e ainda alguns estudos investigando o papel da adjuvância após tratamento cirúrgico inicial, neste caso com evidência extremamente limitada.
Tratamento neoadjuvante pode ser conceituado como a adoção de quimioterapia ou a associação de quimioterapia e radioterapia previamente a um tratamento cirúrgico com intuito curativo de um tumor ressecável. Ele está associado a alguns benefícios bem estabelecidos, como: aumento de ressecções curativas R0, “downstaging” linfonodal e do tumor primário, maior aderência ao esquema terapêutico, tratamento precoce da doença micrometastática e teste da biologia tumoral, evitando procedimentos cirúrgicos mórbidos e desnecessários.
Quimioterapia neoadjuvante
Existem três grandes estudos randomizados que incluíram um número significativo de pacientes com adenocarcinoma de esôfago cujos resultados devem ser comentados em mais detalhes.
O primeiro deles foi o estudo americano INT 113, que arrolou 467 pacientes no período entre 1990 e 1995 e que investigou o papel da quimioterapia (QT) neoadjuvante com 3 ciclos de Cisplatina e 5-Fluoracil. Neste estudo, metade dos indivíduos tinham diagnóstico de adenocarcinoma. Não houve diferença estatística de sobrevida mediana ou em 3 anos entre os grupos. Apenas um aumento de ressecções R0 foi observado com a adição de quimioterapia entre os indivíduos que chegaram a ser operados. Algumas críticas relacionadas a este estudo incluem o atraso no tratamento cirúrgico após a quimioterapia, um número maior de tumores nos estádios I e II e o fato de cerca de metade dos pacientes ter recebido pelo menos um ciclo de QT no pós-operatório12.
Outro estudo foi o MRC (UK Medical Research Council) OE02 “trial”, com 802 indivíduos entre 1992 e 1998. A comparação foi entre tratamento cirúrgico exclusivo e a neoadjuvância com 2 ciclos de Cisplatina e 5-Fluoracil. Cerca de dois terços dos pacientes tiveram diagnóstico de adenocarcinoma. Aqueles tratados com esquema multimodal tiveram sobrevida mediana de 16,8 meses versus 13,3 meses do grupo com cirurgia apenas, com redução de risco de óbito de 16% (HR 0,84; p=0,03). Da mesma maneira que no estudo anterior, críticas importantes devem ser mencionadas, como o resultado numérico de sobrevida dos grupos e o fato de cerca de 10% dos pacientes ter recebido também tratamento com radioterapia13.
Dois estudos randomizados recentes investigaram o papel da quimioterapia neoadjuvante e adjuvante em pacientes com adenocarcinoma de esôfago distal e gástrico. O primeiro deles, o MAGIC Trial, contou com 503 indivíduos e o esquema de quimioterapia proposto foi de ECF (Epirrubicina, Cisplatina e 5-Fluoracil), três ciclos antes e três após a cirurgia. Houve um ganho de sobrevida global em 5 anos de 13% para o braço de pacientes do tratamento multimodal (36% vs. 23%). No entanto, apenas 25% deles tiveram tumores de esôfago distal ou transição esofagogástrica, e neste subgrupo, o ganho de sobrevida não foi significativo14. Houve ainda um “trial” francês com 169 pacientes, novamente demonstrando 14% de ganho de sobrevida com tratamento quimioterapia pré e pós-operatória, porém com duas drogas (Cisplatina e 5-Fluoracil). Seus dados são, no entanto, aplicáveis para os pacientes com adenocarcinoma de esôfago distal e TEG, visto que 75% da população do estudo apresentavam lesões nestas localizações e a análise de subgrupos demonstrou ganho de sobrevida para estes indivíduos15.
Quimioterapia e Radioterapia neoadjuvantes
Existem também três estudos randomizados principais que investigaram o papel da radioterapia associada à quimioterapia neoadjuvantes, seguidas de cirurgia. O primeiro foi publicado em 2005 e envolveu 256 pacientes, 62% com adenocarcinomas. Não houve um ganho significativo de sobrevida global mediana (22 meses vs. 19 meses). Observou-se um aumento significativo de ressecções R0 e de tumores N0 (“downstaging” linfonodal) com o tratamento multimodal. O caráter multicêntrico do estudo e a dose de radioterapia administrada, de 35 Gy, e provavelmente a justificativa da baixa taxa de resposta patológica completa são algumas das justificativas para o resultado negativo. Ainda assim, um ganho significativo foi primeiramente observado para os carcinomas epidermóides (CEC)16.
O primeiro estudo a demonstrar um ganho expressivo de sobrevida com o tratamento multimodal foi o americano CALGB 9781, publicado em 2008. Com uma amostra estimada de 475 pacientes, ele foi interrompido com apenas 56 pacientes por dificuldade de recrutamento. Predominaram os casos de adenocarcinoma e a dose proposta de radioterapia foi de 51,4Gy. A sobrevida mediana do grupo de tratamento multimodal foi de 4,5 anos (1,8 anos no de cirurgia exclusiva) e a sobrevida global em 5 anos foi de 39% (16% para os cirúrgicos exclusivos). Observaram-se maior taxa de resposta patológica completa (33%), de ressecções R0 e tumores N017.
O Cross Trial é o estudo randomizado mais recente a investigar o papel de quimioterapia e radioterapia adjuvantes, e também o de resultados mais consistentes. A quimioterapia consistiu num esquema moderno de bom perfil de toxicidade (Carboplatina e Paclitaxel) e a dose de radioterapia foi de 41Gy. Dentre os 364 pacientes, 75% tinham adenocarcinoma. Houve um ganho significativo de sobrevida global (47% vs. 34%), além de um aumento de 23% de ressecções R0, de 44% de tumores N0 e ainda 26% de casos com resposta patológica completa. As taxas de morbimortalidade foram semelhantes e o braço de pacientes tratados com cirurgia exclusiva apresentou sobrevida superior à observada em todas as outras séries, com um seguimento mediano de aproximadamente 4 anos18.
Estudos comparativos
Existem dois estudos que compararam as duas modalidades de tratamento multimodal, de quimioterapia pré-operatória seguida de cirurgia versus quimioterapia e radioterapia seguidas de cirurgia. Ambos os estudos, um alemão com 119 pacientes e um australiano com 72 pacientes, não apresentaram poder estatístico adequado para as análises pretendidas. As diferenças de sobrevida não foram significativas entre os grupos. No estudo alemão, ela foi um pouco melhor entre os pacientes que fizeram radioterapia, porém o dado não foi significativo, além deste mesmo grupo ter ainda apresentado maior mortalidade pós-operatória. A adição de radioterapia se associou em ambos os estudos a mais ressecções R0 e a um mais significativo clareamento linfonodal19,20.
Em uma meta-análise atualizada em 2011 demonstrou-se uma redução de risco de óbito pela neoplasia com a realização de quimioterapia neoadjuvante de 13%, um ganho absoluto de sobrevida de 5,1% em 2 anos. Quando o tratamento neoadjuvante foi de radioterapia associada à quimioterapia, a redução de risco foi de 22%21.
Em nosso serviço, recomendamos a modalidade de tratamento neoadjuvante de acordo com a proposta cirúrgica. Nos pacientes candidatos a esofagectomia, a proposta é de quimioterapia e radioterapia, aos moldes do protocolo do “Cross Trial”. Naqueles em que há a possibilidade de uma gastrectomia, recomendamos o esquema de quimioterapia peri-operatória9.
Tratamento adjuvante
A evidência para tratamento adjuvante após ressecção de adenocarcinoma de esôfago distal ou transição esofagogástrica é bastante pobre22. O único estudo que leva a alguma recomendação é o INT0116, que investigou o papel de quimioterapia e radioterapia adjuvantes após cirurgia para câncer gástrico ou de transição. No entanto, esta é uma interpretação controversa, visto que apenas 20% da amostra do estudo era de indivíduos com lesões em transição e a cirurgia realizada em todos foi uma gastrectomia23.
Avanços nas Técnicas Cirúrgicas de Esofagectomia
Apesar da grande discussão sobre o papel da ressecção cirúrgica no câncer de esôfago, especialmente após resposta clínica completa em casos de Carcinoma Espinocelular, nossa posição é a de indicar a esofagectomia a todos os pacientes clinicamente aptos, exceto aos que apresentam progressão sistêmica após a neoadjuvância24. Não há dados de literatura que suportem o uso de radio e quimioterapia exclusivas como tratamento curativo para o adenocarcinoma do esôfago e da transição, motivo desta revisão.
Historicamente, a esofagectomia é considerada procedimento complexo, com várias táticas e abordagens cirúrgicas descritas, apresentando altas taxas de morbimortalidade. O desenvolvimento das técnicas anestésicas e de cuidados intensivos, bem como a padronização do procedimento operatório e, especialmente, a concentração destas cirurgias em centros de grande volume foram responsáveis pela progressiva redução destes números, atingindo percentuais de 30 – 40% de risco de complicações pós-operatórias e mortalidade abaixo de 5% nos dias atuais. Sem dúvida, este é o procedimento onde a frequência de execução por serviço e cirurgião mais impactam nos resultados pós-operatórios, com redução estimada da taxa de mortalidade de cerca de 5 vezes entre centros que realizam mais ou menos que 20 esofagectomias anuais25, 26.
Táticas Cirúrgicas
Há grande discussão na literatura sobre qual modalidade de abordagem cirúrgica seria mais adequada para o adenocarcinoma esofágico, se a esofagectomia trans-torácica (ETT) ou a trans-hiatal (ETH). Como a maioria destes tumores acontecem no terço distal, as cadeias linfonodais mais acometidas incluem as mediastinais inferiores, além das para-cárdicas e ao longo da pequena curvatura e arteria gástrica esquerda. A incidência de disseminação linfonodal acima da carina é relativamente baixa, embora haja grande discrepância entre estudos ocidentais e orientais. Obviamente, quanto mais proximais e invasivos os tumores são na parede esofágica, maior o risco de acometimento linfonodal mediastinal alto27.
Este tópico foi investigado por alguns estudos prospectivos e randomizados, o de maior peso publicado em 2002 por um grupo holandês28. Nele, 220 pacientes com adenocarcinoma de esôfago médio e distal foram randomizados para a ressecção via trans-torácia ou trans-hiatal abertas. Este estudo foi bastante criticado principalmente pelo estadiamento considerado incompleto no pré-operatório (nem todos os pacientes realizavam tomografia computadorizada) e pela desproporção dos procedimentos, uma vez que os pacientes do grupo de esofagectomia trans-torácica receberam uma cirurgia estendida, incluindo ressecção enbloc do ducto torácico e veia ázigos. Na análise por intenção de tratamento, não houve diferença estatisticamente significativa em sobrevida. Além disso, a morbidade foi maior no grupo de ETT, mas a mortalidade intra-hospitalar foi semelhante. Em 2007 foi publicada atualização deste estudo, com análise de sobrevida estratificada por acometimento linfonodal e sítio primário de acordo com a classificação de Siewert29. Na análise geral, o ganho de sobrevida numérico do grupo pós ETT continuou sem diferença estatística, mesmo em tumores Siewert I (51% x 37%, p=0,33). O mesmo foi observado para pacientes sem acometimento linfonodal (N0), assim como para aqueles com mais de 8 linfonodos positivos na peça cirúrgica. No entanto, para o subgrupo de pacientes que apresentavam entre 1 e 8 gânglios comprometidos, a diferença de sobrevida de 64% para 23% a favor do grupo de ETT foi estatisticamente significativa, de onde concluíram que a abordagem mais agressiva beneficiaria justamente os pacientes neste cenário, no que pese a dificuldade de se realizar esta estratificação no pré-operatório. Estes achados não se reproduziram em meta-análise posteriormente publicada, permanecendo este debate em aberto30.
Estes dados foram produzidos, no entanto, sem levar em consideração o maior avanço técnico neste campo, que foi a cirurgia minimamente invasiva introduzida por Cuschieri em 199231. Desde então, sucessivas publicações têm demonstrado não só a equivalência oncológica, mas também uma redução significativa da morbidade cirúrgica (incluindo tempo de internação em UTI e hospitalar) da esofagectomia quando um tempo ou todo o procedimento é feito por esta via.
A evidência de maior peso até o momento reside em estudo prospectivo e randomizado publicado em 2012 onde pacientes com câncer de esôfago médio e distal (incluindo CEC e adenocarcinoma) foram aleatorizados para ETT aberta ou minimante invasiva (toracoscopia/laparoscopia)32. Embora com um número pequeno de pacientes recrutados, demonstrou-se que o grupo de cirurgia toracoscópica apresentou significativamente menos infecções pulmonares pós-operatórias, menor tempo de internação e melhor qualidade de vida, sem no entanto reduzir a mortalidade ou impactar na sobrevida a longo prazo.
Este estudo e outras publicações vêm demonstrando os benefícios da realização da cirurgia em posição prona, incluindo o melhor campo operatório, com mais ergonomia ao cirurgião, permitindo menos punções e principalmente prescindindo da ventilação monopulmonar. Teoricamente este posicionamento permitirá inclusive um encurtamento da curva de aprendizado do procedimento. Sua principal desvantagem reside na dificuldade técnica de acesso ao mediastino em caso de necessidade de conversão de emergência33.
Mais recentemente, a cirurgia robótica tem sido acoplada ao armamentário técnico para a realização da esofagectomia minimamente invasiva. A princípio, seu grande diferencial é a visão tridimensional que o console permite ao cirurgião, com maior precisão dos movimentos e segurança na dissecção, além do conforto durante o ato operatório. O prolongado tempo cirúrgico, associado ao custo ainda desproporcional quando comparado à laparoscopia convencional, retardam a difusão mais ampla desta opção terapêutica34.
Conclusão
O tratamento do adenocarcinoma de esôfago vem experimentando considerável avanço nos últimos anos, tanto do ponto de vista de terapia multimodal quanto em técnicas e táticas cirúrgicas. Embora ainda com resultados desanimadores nos pacientes com diagnóstico de doença avançada, nos casos de tumores localizados ou localmente avançados, há a expectativa de cada vez mais se atinja a cura. Os desafios que se impõem diuturnamente aos profissionais ligados a este cuidado são, como em outras áreas, a seleção de cada caso para a sequência terapêutica ideal e, em nosso meio, a garantia do acesso igualitário de todos a esta tecnologia.
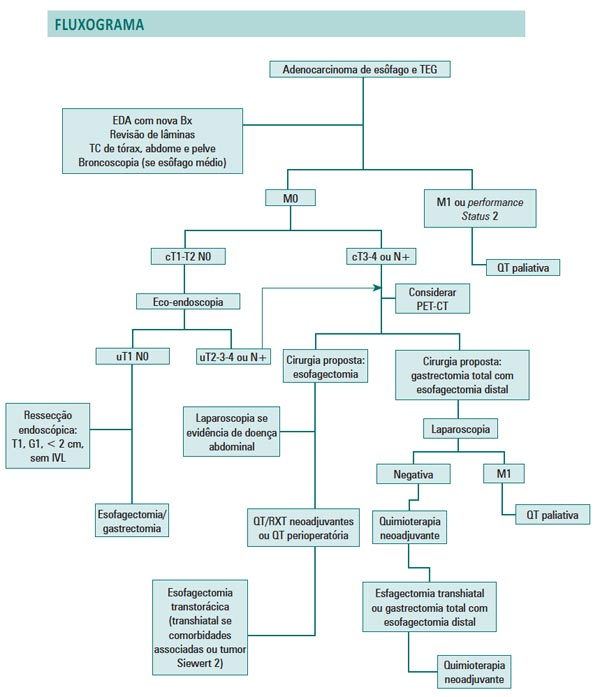 Figura 1. Fluxograma de tratamento multimodal do Adenocarcinoma de esôfago e TEG do Departamento de Cirurgia Abdominal do A.C. Camargo Câncer Center9.
Figura 1. Fluxograma de tratamento multimodal do Adenocarcinoma de esôfago e TEG do Departamento de Cirurgia Abdominal do A.C. Camargo Câncer Center9.
Os autores declaram não haver conflitos de interesse nesta publicação.
Autor(es):
Héber Salvador de Castro Ribeiro -
Wilson Luiz da Costa Jr
AntonioMoris Cury Filho
Igor Correia de Farias
Alessando Landskron Diniz
André Luis de Godoy
Felipe José Fernández Coimbra -
{jd_file file==15}
Referências:
1 – Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM. Estimates of worldwide burden of cancer in 2008. GLOBOCAN 2008. Int J Cancer 2010; 127: 2893-917.
2 – Jemal A, Siegel R, Ward E, Hao Y, Xu J, Thun MJ. Cancer statistics 2009. CA CancerJ Clin 2009; 59: 225-49.
3 – Lepage C, Rachet B, Jooste V, Faivre J, Coleman MP. Continuing rapid increase in esophageal adenocarcinoma in England and Wales. Am J Gastroenterol 2008; 103: 2694-99.
4 – Engel LS, Chow WH, Vaughan TL, et al. Population at tributable risks of esophageal and gastric cancers. J Natl Cancer Inst 2003; 95: 1404-13.
5 – Whiteman DC, Sadeghi S, Pandeya N, et al, and the Australian Cancer Study. Combined effects of obesity, acid reflux and smoking on the risk of adenocarcinomas of the oesophagus. Gut 2008; 57: 173-80.
6 – Shaheen NJ, Richter JE. Barrett`s esophagus. Lancet 2009; 373: 850-61.
7 – Schnell TG, Sontag SJ, Chejfec G, et al. Long-term non surgical management of Barrett`s esophagus with high-grade dysplasia. Gastroenterology 2001; 120: 1607-19.
8 – Pennathur A, Farkas A, Krasinskas AM, et al. Esophagectomy for T1 esophageal cancer: outcomes in 100 patients and implications for endoscopic therapy. Ann Thorac Surg 2009; 87: 1048-55.
9 – Costa Jr Wl, Ribeiro HSC, Farias IC, Diniz AL, Godoy AL, Coimbra FJF. Adenocarcinoma de esôfago distal e transição esofagogástrica (TEG). In: Coimbra, FJF, ed. Câncer do aparelho digestivo alto. Rotinas do Departamento de Cirurgia Abdominal do A. C. Camargo Cancer Center. São Paulo: Atheneu, 2014: 15-27.
10 – Omloo JMT, Lagarde SM, Hulscher JB, et al. Extended transthoracic resection compared with limited transhiatal resection for adenocarcinoma of the mid/distal esophagus: five-year survival of a randomized clinical trial.Ann Surg 2007; 246: 992-1001.
11 – Pennathur A, Gibson MK, Jobe BA, Luketich JD. Oesophageal carcinoma. Lancet 2013; 381: 400-12.
12 – Kelsen DP, Winter KA, Gunderson LL, et al. Long-term results of RTOG trial 8911 (USA Intergroup 113): a random assignment trial comparison of chemotherapy followed by surgery compared with surgery alone for esophageal cancer. J Clin Oncol 2007; 25: 3719-25.
13 – Allum WH, Stenning SP, Bancewicz J, et al. Long-term results of a randomized trial of surgery with or without preoperative chemotherapy in esophageal cancer. J Clin Oncol 2009; 27: 5062-7.
14 – Cunningham D, Allum WH, Stenning SP, et al. Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer. N Engl J Med 2006; 355: 11-20.
15 – Ychou M, Boige V, Pignon JP, et al. Perioperative chemotherapy compared with surgery alone for resectable gastroesophageal adenocarcinoma: an FNCLCC and FFCD multicenter phase III trial. J Clin Oncol 2011; 29: 1715-21.
16 – Burmeister BH, Smithers BM, Gebski V, et al. Surgery alone versus chemoradiotherapy followed by surgery for resectable cancer of the oesophagus: a randomised controlled phase III trial. Lancet Oncol 2005; 6: 659-68.
17 – Tepper J, Krasma MJ, Niedzwiecki D, et al. Phase III trial of trimodality therapy with cisplatin, fluorouracil, radiotherapy, and surgery compared with surgeryalone for esophageal cancer: CALGB 9781. J Clin Oncol 2008; 26: 1086-92.
18 – Van Hagen P, Hulshof MC, van Lanschot JJ, et al. Preoperative chemoradiotherapy for esophageal or junctional cancer. N Engl J Med 2012; 366: 2074-84.
19 – Stahl M, Walz MK, Stuschke M, et al. Phase III comparison of preoperative chemotherapy compared with chemoradiotherapy in patients with locally advanced adenocarcinoma of the esophago gastric junction. J Clin Oncol 2009; 27: 851-6.
20 – Burmeister BH, Thomas JM, Burmeister EA, et al. Is concurrent radiation therapy required in patients receiving preoperative chemotherapy for adenocarcinoma of the esophagus? A randomised phase II trial. Eur J Cancer 2011; 47: 354-60.
21 – Sjoquist KM, Burmeister BH, Smithers BM, et al. Survival after neoadjuvant chemotherapy or chemoradiotherapy for resectable oesophageal carcinoma: an updated meta-analysis. Lancet Oncol 2011; 12:681-92.
22 – Yamasaki M, Miyata H, Miyazaki Y, et al. Perioperative therapy for esophageal cancer. Gen Thorac Cardiovasc Surg 2014. DOI 20.1007/s11748-014-0458-y
23 – MacDonald JS, Smalley SR, Benedetti J, et al. Chemoradiotherapy after surgery compared with surgery alone for adenocarcinoma of the stomach or gastroesophageal junction. N Engl J Med 2001; 345: 725-30.
24 – Coimbra FJF, Diniz AL, Ribeiro HSC, Costa Jr WL, Godoy AL, Farias IC editores. Câncer do Aparelho Digestivo Alto. Manual de condutas terapêuticas do departamento de Cirurgia Abdominal do A.C. Camargo Cancer Center. São Paulo; Atheneu:2013
25 – Birkemeyer JD, Siewers AE, Finlayson EV, et al. Hospital volume and surgical mortality in the United States. N Eng J Med 2002;346(15): 1128-37.
26 –Reames BN, Ghaferi AA, Birkemeyer JD, et al. Hospital volume and operative mortality in the modern Era. Ann Surg 2014; 260(2): 244 – 251.
27 – Stein HJ, Feith M, Siewert JR. Cancer of esophago gastric junction. Surg Oncol 2000; 9(1):35-41.
28 – Hulscher JBF, van Sandick JW, de Boer AGEM, et al. Extended transthoracic resection compared with limited transhiatal resection for adenocarcinoma of esophagus. N Engl J Med 2002; 347:1662-9.
29 –Omloo JM, Lagarde SM, Hulscher JBF, et al. Extended transthoracic resection compared with limited transhiatal resection for adenocarcinoma of the mid/distal esophagus: five-year survival of a randomized clinical trial. Ann Surg 2007; 246(6): 992 – 1000.
30 – Yang C, Chen HN, Chen XZ, et al. Transtoracic resection versus non-transtoracic resection for gastroesophagel junction cancer: a meta-analysis. PloSone 2012;7(6):e37698
31 - Cuschieri A, Shimi S, Banting S. Endoscopic oesophagectomy through a right thoracoscopic approach.J R Coll Edinb. 1992;37:7–11.
32 - Biere SSAY, Henegowen MIB, Mass KW, et al. Minimally invasive versus open oesophagectomy for patients with oesophageal cancer: a multicentre, open-label, randomised controlled trial. Lancet 2012;379:1887-92.
33. Koyanagi K, Osawa S, Tachimori Y. Minimally invasive esophagectomy performed with the patient in a prone position: a systematic review. Surg Today 2015 Apr 10. (Epud ahead of print).
34. Kumar A, Asaf BB. Robotic Thoracic Surgery: the state of the art. J Minim Access Surg 2015; 11(1):60-67.




