Um estudo recentemente publicado na Nature Communications apresentou o primeiro atlas abrangente de metilação de DNA específica de alelo em 39 tipos primários de células humanas. O oncologista Andre Murad (foto) discute os resultados, em mais um tópico da coluna ‘Drops de Genômica’.
Por André Marcio Murad*
Usando algoritmos de aprendizado de máquina e sequenciamento profundo de bissulfito de genoma completo em populações de células recém-isoladas e purificadas, o estudo revela um panorama detalhado da regulação genética e epigenética que pode remodelar nossa compreensão da expressão genética de inúmeras doenças, incluindo o câncer.
Um foco importante da pesquisa é o sucesso na identificação de diferenças entre os dois alelos e, em alguns casos, demonstrar que essas diferenças resultam da impressão genômica — o que significa que não é a sequência genética que importa, mas sim se o alelo é herdado da mãe ou do pai.
Principais achados:
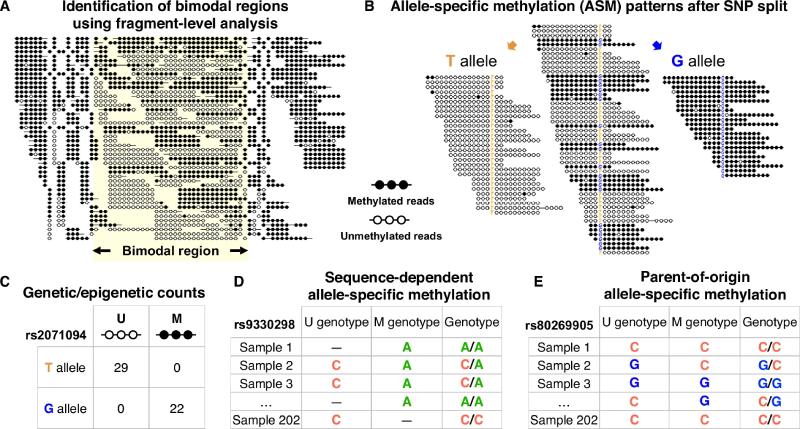
* Escopo da metilação bimodal: Identificação de 325.000 regiões genômicas — aproximadamente 6% do genoma e 11% dos sítios CpG — que exibem um padrão bimodal de moléculas totalmente metiladas e totalmente não metiladas
* Insights específicos de alelo: em 34.000 dessas regiões, as variações genéticas (SNPs) se correlacionam com os padrões de metilação, confirmando a metilação específica de alelo e indicando a extensão da influência genética na metilação de DNA
* Novas descobertas de impressão: Detecção de 460 regiões com metilação específica de alelo parental, incluindo centenas de regiões impressas anteriormente desconhecidas
* Variabilidade específica do tecido: Evidência de que tanto a metilação dependente de sequência quanto a metilação específica do alelo parental são frequentemente exclusivas de tecidos ou tipos de células específicos, revelando uma diversidade até então não apreciada na regulação epigenética em todo o corpo humano
* Implicações para a patogênese de doenças genéticas incluindo o câncer: A validação da metilação específica do tecido e específica do alelo materno do gene CHD7 sugere um mecanismo potencial para o viés paterno observado na herança da síndrome CHARGE (condição genética rara que afeta várias partes do corpo, como olhos, coração, nervos, genitais, cavidade nasal e ouvidos). Esse modelo deve ser expandido para inúmeras outras síndromes hereditárias, incluindo as de predisposição ao câncer.
*André Murad é diretor científico do Grupo Brasileiro de Oncologia de Precisão (GBOP), diretor clínico da Personal - Oncologia de Precisão e Personalizada, professor adjunto coordenador da Disciplina de Oncologia da Faculdade de Medicina da UFMG, e oncologista e oncogeneticista da Clínica OncoLavras





