Em mais um tópico da coluna ‘Drops de Genômica’, o oncologista André Murad (foto) discute os resultados de estudo publicado na revista Cell que revela a complexidade e o Atlas das células B infiltrantes de tumores em 19 tips de câncer. Confira.
Por André Marcio Murad*
Células B atípicas associadas a tumores podem prever a resposta do paciente à imunoterapia, abrindo portas para tratamentos personalizados de câncer. Determinar as características composicionais e fenotípicas das células B infiltrantes de tumores (TIBs) é importante para avançar a compreensão de seu papel no desenvolvimento do câncer.
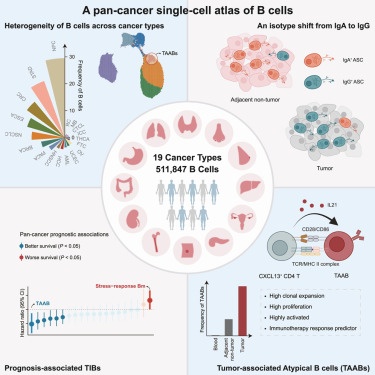
Em um estudo recentemente publicado na revista Cell, os autores estabeleceram um recurso abrangente de células B humanas integrando dados de sequenciamento de RNA de célula única de células B de 649 pacientes em 19 principais tipos de câncer. Eles demonstraram a heterogeneidade substancial em sua abundância total e composição de subtipo e observaram a assimetria da imunoglobulina G (IgG) de isótipos de células secretoras de anticorpos. Além disso, identificaram células B de memória de resposta ao estresse e células B atípicas associadas a tumores (TAABs), duas subpopulações enriquecidas em tumores com potencial prognóstico, compartilhadas de maneira pan-câncer.
Em particular, as TAABs, caracterizadas por um alto nível de expansão clonal e capacidade proliferativa, bem como por interações próximas com células T CD4 ativadas em tumores, são preditivas da resposta à imunoterapia. O recurso integrativo descreveu subconjuntos distintos de TIB clinicamente relevantes, estabelecendo uma base para uma exploração mais aprofundada da semelhança funcional e da diversidade das células B no câncer.
Finalmente, um atlas abrangente de células B humanas foi construído, o que permitiu uma delimitação sistemática do cenário populacional de TIBs no nível pan-câncer, bem como seus padrões de distribuição espacial, estados clonais e dinâmica de desenvolvimento. Os TIBs exibiram uma clara preferência por certos tipos de câncer, com suas abundâncias afetadas tanto pela contextura do órgão quanto por fatores associados ao microambiente tumoral (TME).
O novo atlas também permitiu a identificação de subconjuntos transicionais críticos em meio aos estágios de diferenciação de células B, como células B pré-GC e plasmablastos, dentro de tumores. Particularmente, ficou demonstrada a ocorrência de reações do centro germinativo dentro de tumores semelhantes aos órgãos linfoides secundários (SLOs), com o processo de evolução da sequência dos receptores de células B e as da proteína Speck-like associada à apoptose (ASCs). Essas observações ressaltam o TME como um ecossistema dinâmico que permite ativação e diferenciação de células B in situ.
*André Murad é diretor científico do Grupo Brasileiro de Oncologia de Precisão (GBOP), diretor clínico da Personal - Oncologia de Precisão e Personalizada, professor adjunto coordenador da Disciplina de Oncologia da Faculdade de Medicina da UFMG, e oncologista e oncogeneticista da CETTRO Oncologia (DF)





