 O oncologista André Murad (foto) analisa o TROP-2 (antígeno 2 da superfície celular trofoblástica) como um novo alvo terapêutico em tumores sólidos. Confira, em mais um tópico da coluna ‘Drops de Genômica’.
O oncologista André Murad (foto) analisa o TROP-2 (antígeno 2 da superfície celular trofoblástica) como um novo alvo terapêutico em tumores sólidos. Confira, em mais um tópico da coluna ‘Drops de Genômica’.
Por André Murad*
Embora tenha sido descrito pela primeira vez há quase 40 anos como um marcador na superfície celular de células trofoblásticas, o TROP-2 (antígeno 2 da superfície celular trofoblástica) foi redescoberto nos anos seguintes como transdutor de sinal de cálcio 2 associado ao tumor (TACSTD2), cromossomo componente da membrana 1 marcador de superfície 1 (M1S1), antígeno gastrointestinal 733-1 (GA733-1) e glicoproteína-1 epitelial (EGP-1).
A expressão, o papel e a função do TROP-2 se tornaram interessantes para nós em 1990, quando foi desenvolvido um anticorpo monoclonal que reagiu com uma glicoproteína expressa por muitos tipos diferentes de câncer. O entendimento de que esse anticorpo (renomeado TROP-2 depois de identificado como o mesmo antígeno chamado por diferentes designações) reconheceu um marcador único de células trofoblásticas e neoplásicas foi fortuito, porque foi desenvolvido na busca de um marcador de câncer de pulmão de células não pequenas (CPCNP).
O anticorpo monoclonal murino, designado RS7-3G11 (posteriormente abreviado para RS7), foi desenvolvido imunizando camundongos com uma preparação de membrana celular isolada de uma amostra cirúrgica de um CPCNP escamoso. O RS7 se ligou fortemente às linhas celulares de câncer de pulmão, mama e próstata, fracamente às linhas celulares de câncer de cólon, e estava ausente em uma linha celular de fibroblasto pulmonar, bem como granulócitos, monócitos e linfócitos.
A imuno-histologia de tecidos congelados frescos mostrou que o RS7 se ligava a câncer de mama, cólon, rim, pulmão e próstata (33/40 [83%] positivo, com 22/33 [67%] corando fortemente positivo). Também foi observada fraca coloração em 16/20 tecidos normais da mama, cólon, rim, fígado, pulmão e próstata.
A expressão aumentada de TROP-2 é necessária e suficiente para estimular o crescimento do câncer, enquanto uma quimera de ciclina bicistrônica D1/TROP-2 mRNA é um oncogene.
É importante ressaltar que a expressão elevada está associada a doenças mais agressivas e a um prognóstico ruim em vários tipos de câncer. Essa expressão tumoral elevada de TROP-2 não parece circular no sangue, mas há relatos de que alguns pacientes com câncer de esôfago possuem anticorpos circulantes para esse biomarcador.
Existem pelo menos seis principais vias de sinalização envolvendo TROP-2 na proliferação celular, mas seu papel preciso nessas e em quais vias são críticas em diferentes tipos de câncer e em diferentes abordagens terapêuticas ainda precisam ser elucidadas.
Portanto, a TROP-2 regula o crescimento, a invasão e a propagação do câncer por várias vias de sinalização e tem um papel na biologia das células-tronco e outras doenças.
Mais recentemente, seu papel como alvo de conjugados anticorpo-droga (ADC) ou imunoterapia tem sido extensivamente estudado. Quando o metabólito do irinotecano, SN-38, é conjugado com um anticorpo anti-TROP-2 humanizado (sacituzumabe govitecan), mostra uma ampla atividade anticâncer potente em xenoenxertos de câncer humano e em pacientes com câncer de mama triplo-negativo avançado, câncer de pulmão de células não pequenas e pequenas células, bem como cânceres uroteliais.
Em 22 de abril, a Food and Drug Administration (FDA) aprovou o sacituzumabe govitecan (Trodelvy) para o tratamento de alguns pacientes com câncer de mama triplo negativo, um tumor particularmente agressivo. A aprovação abrange o uso do sacituzumabe govitecano em adultos com câncer de mama triplo negativo que se espalhou ou se metastizou em outras partes do corpo. Sob a aprovação, os pacientes já devem ter sido submetidos a pelo menos dois regimes de tratamento anteriores.
A nova aprovação foi baseada nas descobertas de um ensaio clínico de Fase II patrocinado pela Immunomedics, fabricante do medicamento. O estudo envolveu 108 pacientes com câncer de mama triplo negativo metastático e todos os participantes receberam sacituzumabe govitecan. Um terço dos pacientes que receberam sacituzumabe govitecan teve uma resposta tumoral, o que significa que os tumores diminuíram em pelo menos 30%, de acordo com os resultados do estudo publicado em fevereiro passado na New England Journal of Medicine. A resposta durou em média 7,7 meses. 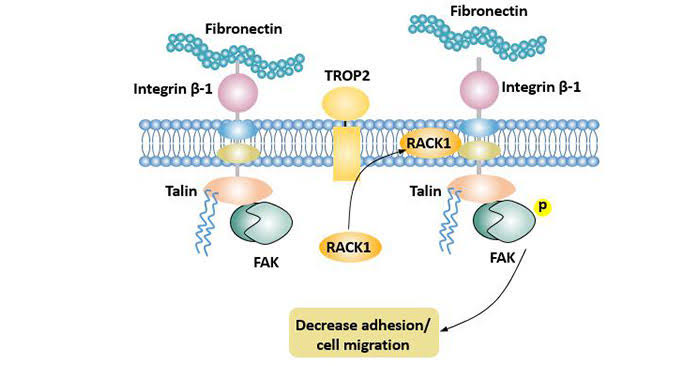
*André Murad é diretor científico do Grupo Brasileiro de Oncologia de Precisão (GBOP), diretor clínico da Personal - Oncologia de Precisão e Personalizada, professor adjunto coordenador da Disciplina de Oncologia da Faculdade de Medicina da UFMG, e oncologista e oncogeneticista da CETTRO Oncologia (DF)




